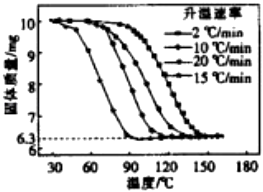
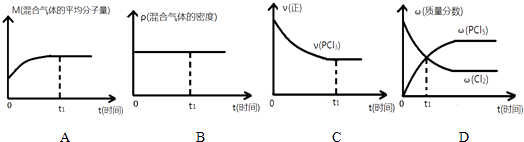
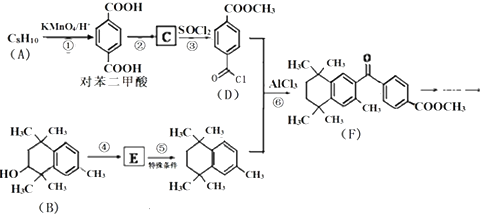
题目内容
【题目】砷(As)广泛分布于自然界,其原子结构示意图是 ![]() .
.
(1)砷位于元素周期表中族,其气态氢化物的稳定性比NH3(填“强”或“弱”).
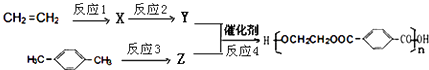
(2)砷的常见氧化物有As2O3和As2O5 , 其中As2O5热稳定性差.根据图1写出As2O5分解为As2O3的热化学方程式: . 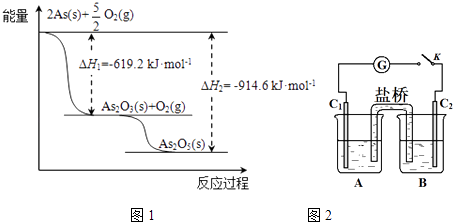
(3)砷酸盐可发生如下反应:AsO43﹣+2I﹣+2HAsO33﹣+I2+H2O.图2装置中,C1、C2是石墨电极
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是 .
②一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针(填“不动”、“向左偏”或“向右偏”).
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样溶于NaOH溶液,得到含AsO43﹣和AsO33﹣的混合溶液.
As2O5与NaOH溶液反应的离子方程式是 .
②上述混合液用0.02500molL﹣1的I2溶液滴定,消耗I2溶液20.00mL.滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000molL﹣1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00mL.(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g.
【答案】
(1)ⅤA;弱
(2)As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ?mol﹣1
(3)AsO43﹣+2H++2e﹣=AsO32﹣+H2O;向左偏
(4)As2O5+6OH﹣═2AsO43﹣+3H2O;0.115
【解析】解:(1)最外层有5个电子,则As位于第ⅤA族,由同主族位置和元素周期律可知,非金属性N>As,则As的气态氢化物的稳定性比NH3弱,所以答案是:ⅤA;弱;(2)由图象可知,As2O5分解为As2O3需要吸收的热量为﹣619kJ/mol﹣(﹣914.6kJ/mol)=+295.4 kJmol﹣1 , 则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4kJmol﹣1 ,
所以答案是:As2O5(s)=As2O3(s)+O2(g)△H=+295.4kJmol﹣1;(3)①B中滴加浓盐酸时发生AsO43﹣+2I﹣+2H+AsO33﹣+I2+H2O,A中C1棒为负极,发生2I﹣﹣2e﹣=I2 , C2为正极发生还原反应,电极反应为AsO42﹣+2H++2e﹣=AsO32﹣+H2O,所以答案是:AsO42﹣+2H++2e﹣=AsO32﹣+H2O;②向B中滴加过量浓NaOH溶液,发生AsO33﹣+I2+2OH﹣AsO43﹣+2I﹣+H2O,C2棒为负极,电子由负极流向正极,可观察到电流计指针向左偏,所以答案是:向左偏.(4)①因为As2O5为碱性氧化物,与NaOH溶液反应生成盐和水,所以离子方程式为:As2O5+6OH﹣═2AsO43﹣+3H2O,所以答案是:As2O5+6OH﹣═2AsO43﹣+3H2O;②上述混合液用0.02500molL﹣1的I2溶液滴定,消耗I2溶液20.00mL,根据AsO33﹣+I2+H2O═AsO43﹣+2I﹣+2H+反应,则消耗AsO33﹣的物质的量为0.02500molL﹣1×20.00×10﹣3L=5×10﹣4mol,新生成的AsO43﹣的物质的量也为5×10﹣4mol;设原As2O5 的物质的量:x,由As2O5→2AsO43﹣ , 则由As2O5 与氢氧化钠反应生成的AsO43﹣的物质的量为2x,后又加入过量的KI,又发生AsO42﹣+2I﹣+2H+═AsO32﹣+I2+H2O,析出的I2又用0.1000molL﹣1的Na2S2O3溶液滴定,发生反应为I2+2Na2S2O3=2NaI+Na2S4O6 , 消耗Na2S2O3溶液30.00mL,
所以有AsO43﹣~I2~2Na2S2O3
1 2
2x+5×10﹣4 0.1×30×10﹣3
解得:x=0.0005 mol
m(As2O5)=0.0005×230=0.115g
所以答案是:0.115.

【题目】常温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是( )
实验编号 | 起始浓度/(molL﹣1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
A.实验①反应后的溶液中:c(K+)>c(A﹣)>c(OH﹣)>c(H+)
B.实验①反应后的溶液中:c(OH﹣)=c(H+)+c(HA)
C.实验②反应后的溶液中:c(A﹣)+c(HA)>0.2 mol/L
D.实验②反应后的溶液中:c(K+)=c(A﹣)>c(OH﹣)=c(H+)