题目内容
【题目】为测定某大理石样品中CaCO3的纯度,称取10.0g大理石样品投入到50mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成1.12L(标准状况)CO2气体。
计算:(1)该大理石样品中CaCO3的质量分数___。
(2)盐酸的物质的量浓度___。
【答案】50% 2mol/L
【解析】
根据碳酸钙与盐酸反应的化学方程式并结合守恒法进行计算。
(1)碳酸钙与盐酸反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O。10.0g大理石样品投入到50mL未知浓度的盐酸中,两者恰好完全反应(杂质不反应),生成1.12L(标准状况)CO2气体,根据碳原子守恒,n(CaCO3)=n(CO2)=![]() ,则m(CaCO3)=0.05mol100g/mol=5g,因此,该大理石样品中CaCO3的质量分数为
,则m(CaCO3)=0.05mol100g/mol=5g,因此,该大理石样品中CaCO3的质量分数为![]() 。
。
(2)依据化学方程式可知,n(HCl)= 2n(CO2)= 0.05mol2=0.1mol,则盐酸的物质的量浓度![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
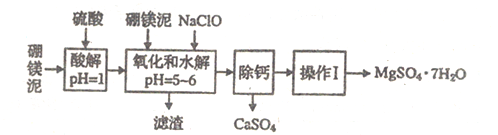
根据题意回答下列问题:
(1)实验中需用1mo/L的硫酸800mL,若用18.4mol/L的浓硫酸来配制,量取浓硫酸时,需使用的量筒的规格为____________
A.10mL B.20mL C.50mL D.100mL
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为_________________。
(3)滤渣的主要成分中除含有Fe(OH)3、Al(OH)3外还有________________。
(4)在“除钙”前,需检验滤波中Fe3+是否被除尽,简述检验方法:______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤: “操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,__________,便得到了MgSO4·7H2O。
(6)实验中提供的硼镁泥共10g,得到的MgSO4·7H2O为17.22g,则MgSO4·7H2O的产率为__________________。
【题目】“飘尘”是物质燃烧时产生的粒子漂浮物,颗粒很小(直径小于10-7m),不易沉降(可漂浮数小时甚至数年),它与空气中SO2、O2接触时,SO2部分转化为SO3,使空气中酸度增加形成酸雨。
(1)下列关于SO2的叙述中,正确的是_____;
A.SO2既可以做氧化剂,也可以做还原剂 B.SO2不是大汽污染物 C.大气中SO2的主要来源是汽车排出的尾气 D.SO2具有漂白性,因而可以使石蕊溶液褪色
(2)下列反应中,SO2表现了还原性的是_______;
A.SO2+H2OH2SO3 B.SO2+2NaOH=Na2CO3+H2O C.2SO2+O2![]() 2SO3 D.SO2+CaO=CaSO3
2SO3 D.SO2+CaO=CaSO3
(3)不能鉴别二氧化碳和二氧化硫的试剂是________;
A.品红溶液 B.澄清石灰水 C.溴水 D.酸性高锰酸钾溶液
(4)下列哪种危害不是酸雨导致的_______;
A.造成洪涝灾害 B.腐蚀建筑物 C.恶化人类环境 D.导致树木枯萎
(5)根据SO2通入不同溶液中实验现象,所得结论不正确的是_______;
溶液 | 现象 | 结论 | |
A | 含HCl、BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2有还原性 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
(6)减少酸雨产生的途径可采取下列的哪些措施___________。
①少用煤做燃料 ②把工厂烟囱造高 ③燃料脱硫 ④飞机、汽车等交通工具采用清洁燃料,如天然气等 ⑤开发新能源
【题目】某课外活动小组设计如图所示装置制取较多量乙酸乙酯。已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
下列说法正确的是
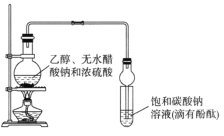
A.装置中球形管既能冷凝蒸气又能防止倒吸
B.反应结束后大试管中的现象是:溶液分层,下层无色油状液体;上层溶液颜色变浅
C.从大试管中分离出的乙酸乙酯中还含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,过滤分离出乙醇
D.最后加入无水硫酸钠,然后进行蒸馏,收集118℃左右的馏分,以得到较纯净的乙酸乙酯。



