题目内容
研究化学反应原理对于生产、生活及环境保护具有重要意义。
(1)工业制硫酸的过程中存在反应: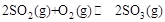 。
。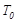 ℃时,将2mol
℃时,将2mol 和1.5 mol
和1.5 mol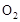 充入2L密闭容器中发生上述反应,容器中
充入2L密闭容器中发生上述反应,容器中 的物质的量随温度变化的曲线如图所示。
的物质的量随温度变化的曲线如图所示。

①图中a点的正反应速率 (填写“>”“<”或
“=”)逆反应速率。
②下列条件可以证明上述反应已经达到化学平衡状态的是 (填写序号)
a.单位时间内消耗1mol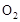 ,同时生成2mol
,同时生成2mol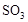
b.容器内 、
、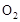 、
、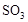 的浓度之比为2∶1∶2
的浓度之比为2∶1∶2
c.容器内压强保持不变
d.混合气体的平均相对分子质量保持不变
③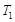 ℃时,上述反应的化学平衡常数K= 。
℃时,上述反应的化学平衡常数K= 。
(2)碳酸铵是一种常用的铵态氮肥,其水溶液显碱性,其原因是 ;溶液中离子浓度关系为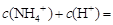 。
。
(3)治理水体重金属离子污染时,首先投入沉淀剂将重金属离子转化为难溶悬浮物,然后再投入氯化铝将污水中的悬浮物除去,从而净化水体,氯化铝的作用是
(用离子方程式表示)。
(1)工业制硫酸的过程中存在反应:
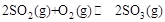 。
。 ℃时,将2mol
℃时,将2mol 和1.5 mol
和1.5 mol 充入2L密闭容器中发生上述反应,容器中
充入2L密闭容器中发生上述反应,容器中 的物质的量随温度变化的曲线如图所示。
的物质的量随温度变化的曲线如图所示。
①图中a点的正反应速率 (填写“>”“<”或
“=”)逆反应速率。
②下列条件可以证明上述反应已经达到化学平衡状态的是 (填写序号)
a.单位时间内消耗1mol
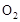 ,同时生成2mol
,同时生成2mol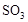
b.容器内
 、
、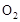 、
、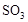 的浓度之比为2∶1∶2
的浓度之比为2∶1∶2c.容器内压强保持不变
d.混合气体的平均相对分子质量保持不变
③
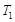 ℃时,上述反应的化学平衡常数K= 。
℃时,上述反应的化学平衡常数K= 。(2)碳酸铵是一种常用的铵态氮肥,其水溶液显碱性,其原因是 ;溶液中离子浓度关系为
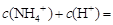 。
。 (3)治理水体重金属离子污染时,首先投入沉淀剂将重金属离子转化为难溶悬浮物,然后再投入氯化铝将污水中的悬浮物除去,从而净化水体,氯化铝的作用是
(用离子方程式表示)。
(1)①>(2分)②cd(2分)③ (2分)
(2分)
(2) 的水解程度大于
的水解程度大于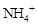 (2分)
(2分) 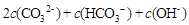 (2分)
(2分)
(3)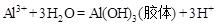 (2分,不标注“胶体”不得分)
(2分,不标注“胶体”不得分)
 (2分)
(2分)(2)
 的水解程度大于
的水解程度大于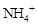 (2分)
(2分) 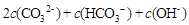 (2分)
(2分)(3)
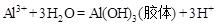 (2分,不标注“胶体”不得分)
(2分,不标注“胶体”不得分)试题分析:(1)①a点处表示
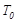 ℃时,2mol
℃时,2mol 和1.5 mol
和1.5 mol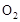 在2L密闭容器开始反应不久,此时反应未达到平衡,故正反应速率>逆反应速率。②a项错误,反应在单位时间内消耗的
在2L密闭容器开始反应不久,此时反应未达到平衡,故正反应速率>逆反应速率。②a项错误,反应在单位时间内消耗的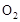 与生成的
与生成的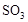 一直为1:2,即无论平衡与否,单位时间内消耗1mol
一直为1:2,即无论平衡与否,单位时间内消耗1mol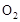 ,同时生成的
,同时生成的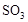 为2mol。
为2mol。B项错误,由化学反应式:
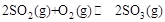 可知,容器内
可知,容器内 、
、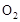 、
、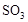 的浓度之比一直都为2∶1∶2,不能有效说明反应平衡。C正确,反应式两边气体压强不相等,当容器内压强保持不变时,说明反应已达到平衡。D项正确,混合气体的平均相对分子质量保持不变,同样说明反应已达到平衡。③图中T1℃时刻的前半段曲线
的浓度之比一直都为2∶1∶2,不能有效说明反应平衡。C正确,反应式两边气体压强不相等,当容器内压强保持不变时,说明反应已达到平衡。D项正确,混合气体的平均相对分子质量保持不变,同样说明反应已达到平衡。③图中T1℃时刻的前半段曲线 的物质的量逐渐减少,表示反应随着温度的升高而逐渐趋向于平衡,T1℃时刻的b点处表示反应已达平衡,T1℃时刻的后半段曲线
的物质的量逐渐减少,表示反应随着温度的升高而逐渐趋向于平衡,T1℃时刻的b点处表示反应已达平衡,T1℃时刻的后半段曲线 的物质的量逐渐增多,表示反应随着温度的升高平衡向逆反应方向移动。
的物质的量逐渐增多,表示反应随着温度的升高平衡向逆反应方向移动。 、
、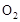 、
、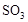 的起始浓度分别为:1mol·L-、0.75mol·L-1、0mol·L-1,平衡时,b处SO2的物质的量浓度为:0.5mol·L-1,则O2剩余的物质的量浓度为:0.5mol·L-1,生成的SO3的物质的量浓度为:0.5mol·L-1,故
的起始浓度分别为:1mol·L-、0.75mol·L-1、0mol·L-1,平衡时,b处SO2的物质的量浓度为:0.5mol·L-1,则O2剩余的物质的量浓度为:0.5mol·L-1,生成的SO3的物质的量浓度为:0.5mol·L-1,故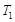 ℃时,上述反应的化学平衡常数
℃时,上述反应的化学平衡常数 L·mol-1。
L·mol-1。(2)CO3 2-的水解方程式:CO3 2- +H2O===HCO3- + OH- 、HCO3- + H2O===H2CO3+OH- ,
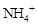 的水解方程式:NH4+ + H2O ="==" NH3.H2O + H+ ,CO3 2-的水解程度大于
的水解方程式:NH4+ + H2O ="==" NH3.H2O + H+ ,CO3 2-的水解程度大于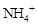 ,溶液中离子浓度关系为c(NH4+)+c(H+)=
,溶液中离子浓度关系为c(NH4+)+c(H+)=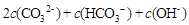
(3)Al3+在水中能够发生水解反应,从而产生Al(OH)3胶体,吸附重金属离子的难溶悬浮物,其离子方程式为:
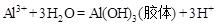 。
。点评:该题综合性较强,全面的考查了学生对化学平衡常数、质量守恒定律、离子水解方程式等相关知识的理解与掌握,具有较强的逻辑思维,而且所涉及的计算量恰到好处,考查了学生的基础演算能力与图像的观察能力。

练习册系列答案
相关题目