题目内容
标准状态下,在四个干燥的烧瓶中分别充入:① 纯净的氨气,② 混有1/3体积空气的氯化氢气体,③ 纯净的NO2气体,④ 混有少量O2的NO2气体。然后各做喷泉实验。实验后,三烧瓶中溶液的物质的量浓度大小关系是
| A.①=②=③=④ | B.①=②=③>④ | C.①=②=③<④ | D.④>①=②>③ |
B
试题分析:气体的体积相等,相同条件下气体的物质的量相等,令气体的物质的量为3mol,则烧瓶的容积为3×22.4L。再判断烧瓶中溶液的体积、溶质的物质的量,再根据物质的量浓度公式判断浓度比。
①纯净的氨气,完全溶于水,溶液的体积等于烧瓶容积,所以溶液浓度为
 ;②混有1/3体积空气的氯化氢气体,氯化氢为1mol,溶液体积等于烧瓶容积的1/3,所以溶液物质的量浓度为
;②混有1/3体积空气的氯化氢气体,氯化氢为1mol,溶液体积等于烧瓶容积的1/3,所以溶液物质的量浓度为 ;③纯净的NO2气体,发生反应3NO2+H2O=2HNO3+NO,生成硝酸2mol,1molNO,所以溶液体积等于烧瓶容积的2/3,所以溶液的物质的量浓度为
;③纯净的NO2气体,发生反应3NO2+H2O=2HNO3+NO,生成硝酸2mol,1molNO,所以溶液体积等于烧瓶容积的2/3,所以溶液的物质的量浓度为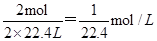 ;④混有少量O2的NO2气体,把NO2分成两部分:第一部分:4NO2+O2+2H2O=4HNO3,由于O2很少,故还有:第二部分:3NO2+H2O=2HNO3+NO.这样第一部分反应中,5份的气体(4NO2+O2)生成4份HNO3,这部分溶液体积等于二氧化氮与氧气的体积,故这部分的浓度为
;④混有少量O2的NO2气体,把NO2分成两部分:第一部分:4NO2+O2+2H2O=4HNO3,由于O2很少,故还有:第二部分:3NO2+H2O=2HNO3+NO.这样第一部分反应中,5份的气体(4NO2+O2)生成4份HNO3,这部分溶液体积等于二氧化氮与氧气的体积,故这部分的浓度为 。第二部分浓度为=
。第二部分浓度为= ,所以比只有NO2气体形成的溶液浓度小,故溶液浓度①=②=③>④,答案选B。
,所以比只有NO2气体形成的溶液浓度小,故溶液浓度①=②=③>④,答案选B。点评:该题是中等难度的试题,试题综合性强,侧重对学生能力的培养。该题的 关键是明确喷泉实验原理、物质的量浓度的计算依据,然后结合题意灵活运用即可。难点是选项④,注意④中把整体分为两部分考虑,关键是判断溶液体积与气体的体积关系。

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
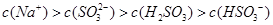
 ,该溶液中:
,该溶液中: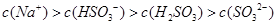
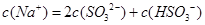

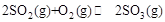 。
。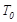 ℃时,将2mol
℃时,将2mol 和1.5 mol
和1.5 mol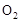 充入2L密闭容器中发生上述反应,容器中
充入2L密闭容器中发生上述反应,容器中
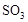
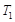 ℃时,上述反应的化学平衡常数K= 。
℃时,上述反应的化学平衡常数K= 。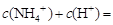 。
。