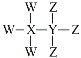题目内容
【题目】按要求填空:
(1)质量数为37的氯原子符号为_______。
(2)S2-的结构示意图为______。
(3)氮原子的电子式为______,N2的电子式为______,NH4+的电子式为_________
(4)磷原子的核外电子排布式为______,其价电子排布式为_____,其价电子排布图为_____。
(5)含有半满p轨道的最轻原子的核外电子排布式为_______,元素名称为_______;
(6)最活泼的非金属元素原子的核外电子排布式为_______,元素名称为_______。
【答案】![]() Cl
Cl ![]()
![]()
![]()
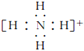 1s22s22p63s23p3 3s23p3
1s22s22p63s23p3 3s23p3 ![]() 1s2s22p3 氮 1s22s22p5 氟
1s2s22p3 氮 1s22s22p5 氟
【解析】
(1)元素符号左下角的数字为质子数,左上角的数字为质量数,质量数为37的氯原子符号为![]() Cl,故答案为:
Cl,故答案为:![]() Cl;
Cl;
(2)S2-的质子数为16,核外电子数为18,则硫离子结构示意图为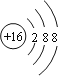 ,故答案为:
,故答案为: ;
;
(3)N原子最外层电子数为5,其电子式为![]() ,氮气中N原子均满足最外层8电子稳定结构,其电子式为
,氮气中N原子均满足最外层8电子稳定结构,其电子式为![]() ,铵根离子在含4个N-H键,其电子式为
,铵根离子在含4个N-H键,其电子式为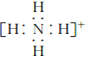 ,故答案为:
,故答案为:![]() ;
;![]() ;
;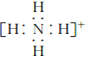 ;
;
(4)P的质子数为15,最外层电子数为5,则磷原子的核外电子排布式为1s22s22p63s23p3,其价电子排布式为3s23p3,其价电子排布图为![]() ,故答案为:1s22s22p63s23p3;3s23p3;
,故答案为:1s22s22p63s23p3;3s23p3;![]() ;
;
(5)含有半满p轨道的最轻原子,其最外层电子为2s22p3,原子序数为7,其电子排布式为:1s2s22p3,为氮元素,故答案为:1s2s22p3;氮;
(6)最活泼的非金属元素为F元素,电子排布式为1s22s22p5,故答案为:1s22s22p5;氟。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
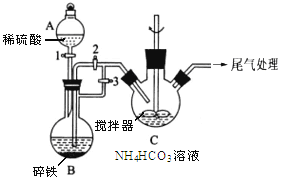
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
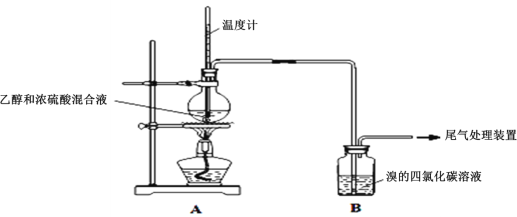
操作 | 现象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有___性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___;
②乙根据现象认为实验中产生的SO2和___,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
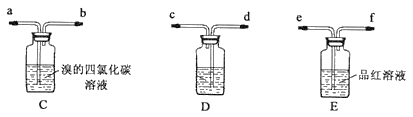
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___;乙设计的实验D中盛放的试剂是___,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
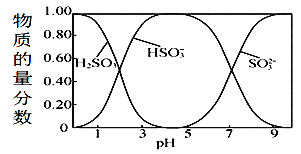
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___。
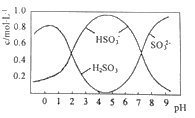
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___mol·L-1。