题目内容
【题目】乳酸亚铁晶体([CH3CH(OH)COO]2Fe·3H2O,Mr=288) 可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。
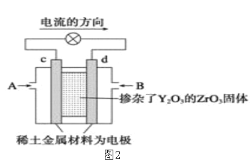
Ⅰ.制备碳酸亚铁(装置如图所示)
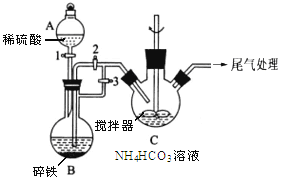
(1)仪器A的名称是______________ ;
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是___________________________________________________________;然后关闭活塞1,接下来的操作是_______________; 装置C中发生反应的离子方程式为______________ 。
Ⅱ.制备乳酸亚铁
向纯净的FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应。
(3)为防止乳酸亚铁变质,在上述体系中还应加入____________________________________________________________________________
(4)为证明乳酸亚铁中含有Fe2+,选择的检验试剂为_______________________________________________________________________;
Ⅲ. 乳酸亚铁晶体纯度的测量
经过过滤、隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥等操作,获得乳酸亚铁晶体后
(5)两位同学分别用不同的方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是_________________________________________________________________________________________________________________
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+被还原为Ce3+),称取6.00g样品配成250.00mL溶液,取25mL,用0.1 molL—1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为_______________________________________。
【答案】分液漏斗 排尽装置内的空气,防止亚铁被氧化 关闭活塞3,打开活塞2; Fe2++2HCO3=FeCO3↓+CO2↑+H2O 适量铁粉 KSCN溶液与新制氯水或铁氰化钾溶液 乳酸根中羟基被酸性高锰酸钾溶液氧化,导致消耗酸性高锰酸钾溶液的量偏多 96%
【解析】
(1)基本的实验仪器,答案为分液漏斗;
(2)碎铁中加入稀硫酸,生成氢气,排尽装置中的空气,可以防止生成的Fe2+被氧气氧化,排除空气后,在C中生成FeCO3,需要将B中的压强增大,使B中生成的Fe2+通过导管压到C装置中,操作为关闭活塞3,打开活塞2;在C中生成FeCO3,原料为Fe2+和HCO3-,根据电荷守恒可以写出方程式。答案为排尽装置内的空气,防止亚铁被氧化 关闭活塞3,打开活塞2 Fe2++2HCO3=FeCO3↓+CO2↑+H2O;
(3)Fe2+容易被氧气氧化,可以加入铁粉,使生成的Fe3+和Fe反应生成Fe2+,答案为适量铁粉;
(4)检验Fe2+可以使用铁氰化钾,或者先加KSCN溶液不变色、用加氯水将可能存在的Fe2+氧化成Fe3+再观察是否有血红色出现。答案为KSCN溶液与新制氯水或铁氰化钾溶液;
(5)①乳酸中羟基也能和酸性高锰酸钾溶液反应,消耗的高锰酸钾变多,所以纯度超过100%。②Ce4+被还原为Ce3+,Fe2+化合价升高生成Fe3+,化合价升降守恒,物质的量比例为1:1,![]() ,
,![]() ,250mL溶液取25mL,则原样品中有Fe2+ 0.02mol,[CH3CH(OH)COO]2Fe·3H2O的质量m=Mr×n=288×0.02g=5.76g,
,250mL溶液取25mL,则原样品中有Fe2+ 0.02mol,[CH3CH(OH)COO]2Fe·3H2O的质量m=Mr×n=288×0.02g=5.76g,![]() ,答案为乳酸根中羟基被酸性高锰酸钾溶液氧化,导致消耗酸性高锰酸钾溶液的量偏多 96%。
,答案为乳酸根中羟基被酸性高锰酸钾溶液氧化,导致消耗酸性高锰酸钾溶液的量偏多 96%。