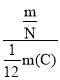��Ŀ����
����Ŀ��������ԭ��Ӧ��Ӧ�ñȽϹ㷺���Ķ�����IJ��ϣ������ػ�ѧ֪ʶ�ش��������⡣�ڻ�ҩ��Ҫ������ء���ǡ�ľ̿���߷�ĩ�Ļ����ڵ�ȼ�����£��仯ѧ��Ӧʽ��ҪΪ��2KNO3+S+3C=N2��+3CO2��+K2S
��1���ںڻ�ҩȼ�յķ�Ӧ�У�������Ϊ___��
��2���÷�Ӧ��������Ԫ����___��
��3���÷�Ӧ������������___��
��4��KNO3��NԪ�صĻ��ϼ���___��
��5�����ݻ�ѧ��Ӧʽ������һ����ԭ�Ӳ��뷴Ӧʱת��___�����ӣ�
��6����Cl2ͨ��Ũ��ˮ�У��������·�Ӧ��3Cl2+8NH3=6NH4Cl+N2����˫���ű�ʾ��Ӧ�ĵ���ת�Ʒ������Ŀ��___��
��7����֪�������з�Ӧ����ClO3-��5Cl-��6H+ =3Cl2��3H2O ��2Fe2+��Cl2=2Fe3+��2 Cl-����ClO3-��Fe3+��Cl2����������������ǿ������˳����___��
���𰸡�KNO3��S C CO2 +5 2 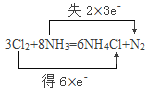 ClO3����Cl2��Fe3��
ClO3����Cl2��Fe3��
��������
��1��������ָ�ڷ�Ӧ����Ԫ�ػ��ϼ۽��͵����ʣ��ڷ�Ӧ��KNO3��NԪ����+5��Ϊ0�ۡ�S��0�۽�Ϊ-2�ۣ�������������KNO3��S��
��2����������Ԫ����ָ�ڷ�Ӧ�л��ϼ����ߵ�Ԫ�أ�C��0������Ϊ+4�ۣ���C��������
��3��C��0������Ϊ+4�ۣ���C���������÷�Ӧ������������CO2��
��4�����ݻ�������Ԫ�ص��������ϼ۴�����Ϊ0��KNO3��NԪ�صĻ��ϼ���+5��
��5����Ӧ��S��0�۽�Ϊ-2�ۣ��õ�2�����ӣ����ݻ�ѧ��Ӧʽ������һ����ԭ�Ӳ��뷴Ӧʱת��2�����ӣ�
��6����Ӧ3Cl2+8NH3=6NH4Cl+N2�У�ClԪ�ػ��ϼ���0��-1�ۣ�NԪ�ػ��ϼ���-3����0�ۣ�������ԭ��Ӧ�������뻹ԭ����ʧ������Ŀ��ȣ�����Ϊ���ϼ�����������ȣ���˫���ű������ת�Ƶķ������Ŀ��Ϊ�� ��
��
��7��ͬһ������ԭ��Ӧ�У��������������Դ�����������������ԣ���ԭ���Ļ�ԭ�Դ��ڻ�ԭ����Ļ�ԭ�ԣ���Ӧ��ClO3-��5Cl-��6H+ =3Cl2��3H2O ��ClO3������������Cl2�������������������ClO3����Cl2����Ӧ��2Fe2+��Cl2=2Fe3+��2 Cl-��Cl2����������Fe3��������������������ԣ�Cl2��Fe3������ClO3-��Fe3+��Cl2����������������ǿ������˳����ClO3����Cl2��Fe3����