题目内容
标准状态下,气态分子断开l mol化学键的焓变称为键焓。已知H-H、H-O和O-O键的键焓ΔH分别为436 kJ/mol、463 kJ/mol和495kJ/mol。下列热化学方程式正确的是
A.H2O (g)= H2(g)+ O2(g); ΔH=" -485" kJ/mol O2(g); ΔH=" -485" kJ/mol |
B.H2O (g)=H2(g)+ O2(g); ΔH="=+485" kJ/mol O2(g); ΔH="=+485" kJ/mol |
| C.2H2(g)+ O2 (g)= 2H2O(g) ΔH =" +485" kJ/mol |
| D.2H2(g)+ O 2(g)=2H2O(g) ΔH =" -485" kJ/mol |
D
试题分析: 1mol的气态水分解产生1mol的氢气和1/2mol的氧气的能量变化是:2×463 kJ-436-1/2×495="242." 5.因此热化学方程式为H2O (g)= H2(g)+
 O2(g); ΔH=" +242." 5kJ/mol。A.B错误。则若是2mol的气态水分解产生2mol的氢气和1mol的氧气的能量变化是:+485kJ.物质分解吸收的热量与产物燃烧放出的热量数值相等。即热挥发方程式是2H2(g)+ O2 (g)= 2H2O(g) ΔH =" -485" kJ/mol 。 C错误,D正确。
O2(g); ΔH=" +242." 5kJ/mol。A.B错误。则若是2mol的气态水分解产生2mol的氢气和1mol的氧气的能量变化是:+485kJ.物质分解吸收的热量与产物燃烧放出的热量数值相等。即热挥发方程式是2H2(g)+ O2 (g)= 2H2O(g) ΔH =" -485" kJ/mol 。 C错误,D正确。 
练习册系列答案
相关题目
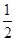 Cl2(g)===NaCl(s) ΔH1
Cl2(g)===NaCl(s) ΔH1
 2SO3(g)
2SO3(g) 2SO3(g) △H= 。
2SO3(g) △H= 。