题目内容
【题目】金属铁及其化合物在合金材料以及催化剂等方面应用广泛。
(1)Fe3+的电子排布式为___________________。已知,Fe3+的化学性质比Fe2+稳定,请从原子结构的角度进行解释_____________________________________________________。
(2)Fe能与CO形成配合物Fe(CO)5,1 mol Fe(CO)5中含有________ mol σ键
(3)与CO互为等电子体的分子和离子分别为_______和_______(各举一种即可,填化学式)
(4)已知某铁晶体的晶胞结构如图所示。
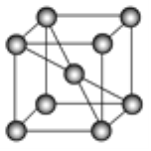
①该晶胞中含有铁原子的数目为___________。
②若晶胞的边长为a cm,则晶体铁的密度为_______________________g·cm-3(用代数式表示,阿伏加德罗常数为NA)。
【答案】 1s22s22p63s23p63d5或[Ar]3d5 Fe3+的3d轨道填充了5个电子,为半充满状态 10 N2 CN- 2 ![]()
【解析】试题分析:本题考查离子核外电子排布式的书写、σ键的计算、等电子体的书写、晶胞的分析和计算。
(1)Fe原子核外有26个电子,基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,Fe3+的电子排布式为1s22s22p63s23p63d5。Fe3+的价电子排布式为3d5,Fe2+的价电子排布式为3d6,Fe3+的3d轨道填充了5个电子,为半充满状态,较稳定,Fe3+的化学性质比Fe2+稳定。
(2)CO的结构式为C![]() O,1个CO分子中含1个σ键,1个Fe与5个CO形成5个配位键,配位键也是σ键,1个Fe(CO)5中含有10个σ键,1molFe(CO)5中含有10molσ键。
O,1个CO分子中含1个σ键,1个Fe与5个CO形成5个配位键,配位键也是σ键,1个Fe(CO)5中含有10个σ键,1molFe(CO)5中含有10molσ键。
(3)用替代法,与CO互为等电子体的分子为N2,离子有CN-、C22-等。
(4)①用“均摊法”,该晶胞中含有的铁原子数:8![]() +1=2个。
+1=2个。
②晶胞的体积为a3cm3,1mol晶体的体积为![]() NAcm3,1mol晶体的质量为56g,晶体铁的密度为56g
NAcm3,1mol晶体的质量为56g,晶体铁的密度为56g![]() (
(![]() NAcm3)=
NAcm3)=![]() g/cm3。
g/cm3。