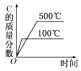
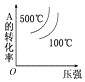
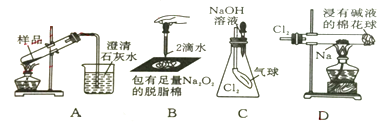
题目内容
【题目】A、B、C、D、E五种短周期主族元素的原子序数依次增大,已知:
①其原子半径大小关系是D>E>B>C>A;
②A、D同主族,B、C、E分处三个连续的主族,且最外层电子数依次增加;
③C是地壳中含量最多的元素,D与C可形成原子个数比为1∶1或2∶1的化合物。
请填写以下空白:
(1)单质B的电子式为____________,结构式为____________。
(2)化合物D2C2的电子式为________________。用电子式表示D2C的形成过程:__________________________。
(3)单质A和单质B在一定条件下发生反应的化学方程式为_________________。
(4)单质E与A、C、D三种元素形成的化合物发生反应的化学方程式为___________。
【答案】 ![]() N≡N
N≡N ![]()
![]() N2+3H2
N2+3H2![]() 2NH3 Cl2+2NaOH===NaClO+NaCl+H2O
2NH3 Cl2+2NaOH===NaClO+NaCl+H2O
【解析】C是地壳中含量最多的元素,C为氧,由D与C可形成原子个数比为1∶1或2∶1的化合物知D为氢或钠,又因原子序数依次增大,则D为钠,A为氢,又B、C、E分处三个连续的主族,且最外层电子数依次增加,则B为氮,E为氯。则
(1)氮气的电子式为![]() ,结构式为N≡N;(2)化合物D2C2是过氧化钠,电子式为
,结构式为N≡N;(2)化合物D2C2是过氧化钠,电子式为![]() 。D2C是氧化钠,其形成过程为
。D2C是氧化钠,其形成过程为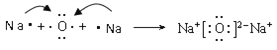 。(3)单质A和单质B在一定条件下发生反应生成氨气,反应的化学方程式为N2+3H2
。(3)单质A和单质B在一定条件下发生反应生成氨气,反应的化学方程式为N2+3H2![]() 2NH3。(4)单质E是氯气,与A、C、D三种元素形成的化合物氢氧化钠发生反应的化学方程式为Cl2+2NaOH=NaClO+NaCl+H2O。
2NH3。(4)单质E是氯气,与A、C、D三种元素形成的化合物氢氧化钠发生反应的化学方程式为Cl2+2NaOH=NaClO+NaCl+H2O。

【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图: 
![]()
![]() +H2O,
+H2O, 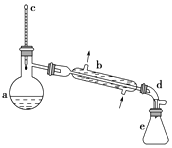
可能用到的有关数据如表:
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓H2SO4 , b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环己烯12g.
回答下列问题:
(1)装置b的名称是 .
(2)本实验中最容易产生的副产物的结构简式为 , 生成该物质的反应类型是
(3)分液漏斗在使用前须清洗干净并 , 在本实验分离过程中,产物应该从分液漏斗的(填“上口倒出”或“下口倒出”).
(4)在环己烯粗产物蒸馏过程中,不可能用到的仪器有(填正确答案标号).
A.蒸馏烧瓶
B.温度计
C.分液漏斗
D.锥形瓶
E.蒸发皿
(5)本实验所得到的环己烯产率是 .