题目内容
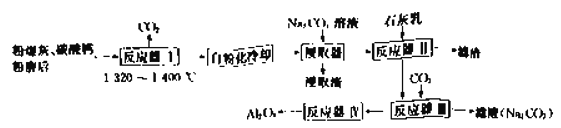
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:

(1)工业生产纯碱的第一步是除去饱和食盐水的中SO42-、Ca2+离子,依次加入的试剂及其用量是______________、_______________、过滤、_______________。
(2)已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
①写出装置I中反应的化学方程式_____________________________________。
②写出装置II中发生反应的化学方程式________________________________。
(3)该流程中可循环利用的物质是__________________。
(4)若制出的纯碱中只含有杂质NaCl。
①检验用该纯碱配制的溶液中含有Cl―的方法是_________________________。
②向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g,则该纯碱的纯度(质量分数)为__________(用m、b来表示)。
【答案】过量BaCl2溶液 过量Na2CO3溶液 适量(过量)稀盐酸 NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl 2NaHCO3![]() Na2CO3+H2O+CO2 ↑ CO2 取少量纯碱样品,加入足量的稀硝酸,再加入硝酸银溶液,若生成白色沉淀,则说明含有氯离子。
Na2CO3+H2O+CO2 ↑ CO2 取少量纯碱样品,加入足量的稀硝酸,再加入硝酸银溶液,若生成白色沉淀,则说明含有氯离子。 ![]() ×100%
×100%
【解析】
(1)工业上除去SO42-用含有Ba2+的可溶性盐、除去Ca2+用含有CO32-的可溶性盐;
(2)①NaCl、CO2、NH3、H2O发生反应生成NaHCO3和NH4Cl;
②受热条件下,碳酸氢钠分解生成碳酸钠、二氧化碳和水;
(3)装置II中得到二氧化碳,装置I中需要二氧化碳;
(4)①Cl-的检验常用硝酸酸化的硝酸银溶液,生成不溶于稀硝酸的AgCl沉淀;
②向m克纯碱样品中加入足量CaCl2溶液反应生成碳酸钙,则最后得到的bg为碳酸钙的质量,根据碳原子守恒由碳酸钙的物质的量可得到碳酸钠的物质的量,在求算出理论上碳酸钠的质量,进而求算纯碱的纯度。
(1)除去饱和食盐水的中SO42-要用BaCl2溶液,除去饱和食盐水的中Ca2+要用Na2CO3溶液,并且除杂时试剂应该过量,最后用稀盐酸调节pH=7,
故答案为:足量BaCl2溶液、足量Na2CO3溶液、适量稀盐酸;
(2)①先向食盐水中通入NH3使溶液呈碱性,CO2、NH3和H2O反应生成NH4HCO3,由于溶解度小NaHCO3,所以NaCl和NH4HCO3反应生成NaHCO3和NH4Cl,即
NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl,
故答案为:NaCl+CO2+NH3+H2O═NaHCO3↓+NH4Cl;
②NaHCO3对热不稳定,受热易分解生成Na2CO3、H2O、CO2,化学方程式为2NaHCO3![]() Na2CO3+H2 O+CO2 ↑,
Na2CO3+H2 O+CO2 ↑,
故答案为:2NaHCO3![]() Na2CO3+H2O+CO2 ↑;
Na2CO3+H2O+CO2 ↑;
(3)装置II中得到二氧化碳,装置I中需要二氧化碳,所以能循环利用的是二氧化碳,故答案为:CO2;
(4)①Cl-的检验常用硝酸酸化的硝酸银溶液,方法为:取少量纯碱样品溶于水,加入足量的稀硝酸,再加入硝酸银溶液,若生成白色沉淀,则说明其中含有氯离子;
故答案为:取少量纯碱样品溶于水,加入足量的稀硝酸,在加入硝酸银溶液,若生成白色沉淀,则说明其中含有Cl-;
②向m克纯碱样品中加入足量CaCl2溶液反应生成碳酸钙,则最后得到的bg为碳酸钙的质量,则根据碳原子守恒,碳酸钠的物质的量=碳酸钙的物质的量=![]() =
=![]() ,则碳酸钠的质量=nM=
,则碳酸钠的质量=nM=![]() ×106g/mol=
×106g/mol=![]() g,则该纯碱的纯度=
g,则该纯碱的纯度=![]() ×100%=
×100%=![]() ×100%;
×100%;
答案为:![]() ×100%。
×100%。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案