题目内容
【题目】某小组探究纯净物M(由2种短周期元素组成)的化学式,进行如图实验(气体体积均在标准状况下测定):
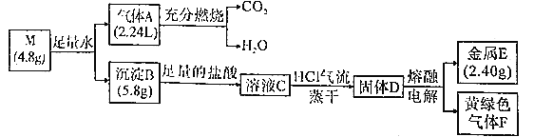
实验测定,①2.40g金属E与稀硫酸按n(E):n(H2SO4)=1:1反应能放出2.24LH2(标准状况);②金属E能在NH3中剧烈燃烧,当E和NH3按n(E):n(NH3)=1:2反应时产物的物质的量之比为1:1。
回答下列问题:
(1)A分子的结构式为___。
(2)M的化学式为___。
(3)M与水反应的化学方程式为___。
(4)E在氨气中燃烧的化学方程式为___。
(5)蒸干C溶液中HCl的作用是___。
(6)电解熔融D时阳极的电极反应式为__。
【答案】HC≡CH MgC2 MgC2+2H2O=Mg(OH)2+C2H2↑ Mg+2NH3![]() Mg(NH2)2+H2↑ 抑制MgCl2水解 2Cl--2e=Cl2↑
Mg(NH2)2+H2↑ 抑制MgCl2水解 2Cl--2e=Cl2↑
【解析】
由实验①知,n(H2)=0.1mol,n(E)=n(H2SO4)=0.1mol,E的质量为2.4g,E的相对原子质量为24,E为镁。由实验②知,镁与氨气反应生成Mg(NH2)2和H2,NH3类似H2O。由气体A燃烧生成CO2和H2O可知,气体A含有C,H元素,说明M是由镁和碳两种元素组成,设M的化学式为MgCn,与水反应生成5. 8gMg(OH)2,4.8gM中含有C的物质的量为4.8g-![]() =0.2mol,n(A)=0.1mol,说明M的化学式为MgC2,气体A为C2H2。
=0.2mol,n(A)=0.1mol,说明M的化学式为MgC2,气体A为C2H2。
(1)C2H2中的C和C之间存在三键,分子的结构式为:HC≡CH;
(2)M为碳化镁,类似碳化钙,化学式为:MgC2;
(3)碳化镁与水反应生成氢氧化镁和乙炔(C2H2),化学方程式为MgC2+2H2O=Mg(OH)2+C2H2↑;
(4)镁在氨气中燃烧的条件是“点燃”,燃烧的化学方程式为:Mg+2NH3![]() Mg(NH2)2+H2↑。
Mg(NH2)2+H2↑。
(5)MgCl2在水中水解,氯化氢作用是抑制氯化镁水解,制备无水氯化镁;
(6)电解熔融氯化镁时阴极发生还原反应生成镁,阳极上发生氧化反应生成氯气,电极反应式为2Cl--2e=Cl2↑;

 小学课时特训系列答案
小学课时特训系列答案