��Ŀ����
��6�֣���20L���ݵ��ܱ������У�����3mo1SO3(g)��lmo1��������һ���¶���ʹ�䷴Ӧ����Ӧ��4minʱ��������Ũ��Ϊ0.09 mol·L-1������Ӧ��8minʱ����Ӧ����ƽ�⣬��ʱ��������Ũ��c(SO3)=" a" mol·L-1��
(1��0min��4min������O2ƽ������v(O2)= mol·L-1·min-1
(2)�ﵽƽ��ʱc(O2)=c(SO2)����a= mol·L-1������������ϵ������0min��8min��֮��SO2��O2��SO3Ũ����ʱ��仯����.
(3)����ʼʱ���±�����Ͷ�ϣ���ͬ�¶��´ﵽƽ��ʱ����������Ũ�ȴ���a mol·L-1����
| | A | B | C | D |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
(1) 0.01mol/L. min��1�֣�
(2) a="0.05" mol/L ��1�֣� ͼ�����ң�2�֣�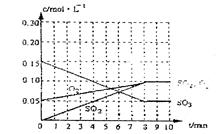
(3) BD
������������� ��������ʽ���
2SO3 ? 2SO2 + O2
��ʼ���ʵ���Ũ�� 3/20 0 1/20
�仯���ʵ���Ũ�� 0.08 0.08 0.04
4Min���ʵ���Ũ�� 0.07 0.08 0.09
����(1��0min��4min������O2ƽ������v(O2)= 0.01mol/L. min
��������ʽ���
2SO3 ? 2SO2 + O2
��ʼ���ʵ���Ũ�� 3/20 0 1/20
�仯���ʵ���Ũ�� 2x 2x x
8Minƽ�����ʵ���Ũ�� a =0.15-2x 2x 0.05- x
�ﵽƽ��ʱc(O2)=c(SO2)�� 2x = 0.05- x ���� x=0.05 ����a =0.15-2x=0.05
(2)�ﵽƽ��ʱc(O2)=c(SO2)����a="0.05" mol/L������������ϵ������0min��8min��֮��SO2��O2��SO3Ũ����ʱ��仯���� 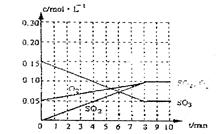
���㣺��ѧƽ�� ��Чƽ�� ��ѧ��Ӧ����
���������ڻ�ѧƽ��ļ���ѧ������Ҫ���յ�֪ʶ�У�����ʽ; ��ѧ��Ӧ���ʵļ��㹫ʽ��v=��c/��t ;��Чƽ������������
I�ࣺ���º����¶��ڷ�Ӧǰ��������������仯�ķ�Ӧ��˵������V��0����ϵ�����ȼ�ת����Ӧ��������ʼͶ�ϵ����ʵ�����ԭƽ����ʼ̬��ͬ��
II�ࣺ���º����¶��ڷ�Ӧǰ���������û�б仯�ķ�Ӧ��˵������V=0����ϵ�����ȼ�ת����ֻҪ��Ӧ�������������ʵ����ı�����ԭƽ����ʼ̬��ͬ����ƽ���Ч��
III�ࣺ���º�ѹ�¶���������ϵ��Чת����ֻҪ��Ӧ�������������ʵ����ı�����ԭƽ����ʼ̬��ͬ����ƽ���Ч��

 ��20L���ݵ��ܱ������У�����3molSO3��g����1mol��������һ���¶���ʹ�䷴Ӧ����Ӧ��4minʱ��������Ũ��Ϊ0.09mol?L-1������Ӧ��8minʱ����Ӧ����ƽ�⣬��ʱ��������Ũ��c��SO3����a mol?L-1��
��20L���ݵ��ܱ������У�����3molSO3��g����1mol��������һ���¶���ʹ�䷴Ӧ����Ӧ��4minʱ��������Ũ��Ϊ0.09mol?L-1������Ӧ��8minʱ����Ӧ����ƽ�⣬��ʱ��������Ũ��c��SO3����a mol?L-1��
 ��20L���ݵ��ܱ������У�����3molSO3��g����1mol��������ij�¶���ʹ�䷴Ӧ����Ӧ��4minʱ��������Ũ��Ϊ0.06mol/L������Ӧ��8minʱ����Ӧ����ƽ�⣮
��20L���ݵ��ܱ������У�����3molSO3��g����1mol��������ij�¶���ʹ�䷴Ӧ����Ӧ��4minʱ��������Ũ��Ϊ0.06mol/L������Ӧ��8minʱ����Ӧ����ƽ�⣮
