题目内容
在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡.
(1)0min-4min内生成O2的平均速率v(O2)=______mol/(L?min)
(2)整个过程中,各物质的浓度与时间关系如图所示,则该温度下的平衡常数
K=______
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05mol/L的是______,此时的平衡常数与(2)小题比较______(填“大于”、“小于”或“等于”)
(4)物质的浓度不再改变标志该反应已达平衡,下列还可以说明该反应已达平衡的是______(填序号)
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均分子量不再改变
④V正(SO3)=2V逆(O2)
⑤n(SO3):n(O2):n(SO2)=2:1:2.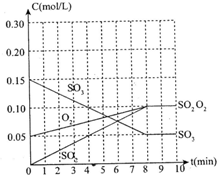
(1)0min-4min内生成O2的平均速率v(O2)=______mol/(L?min)
(2)整个过程中,各物质的浓度与时间关系如图所示,则该温度下的平衡常数
K=______
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05mol/L的是______,此时的平衡常数与(2)小题比较______(填“大于”、“小于”或“等于”)
| A | B | C | D | |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
①体系内压强不再改变
②容器内气体的密度不再改变
③混合气体的平均分子量不再改变
④V正(SO3)=2V逆(O2)
⑤n(SO3):n(O2):n(SO2)=2:1:2.

(1)根据反应速率之比等于化学计量数之比,则有v(O2)=2v(SO3)=2×
=2×
=0.025mol?L-1?min-1,故答案为:0.025mol?L-1?min-1;
(2)k=
=
=0.4mol?L-1,故答案为:0.4mol?L-1;
(3)A、因反应为可逆反应,2molSO2不可能完全转化为SO3,所以相同温度下达到平衡时,三氧化硫浓度小于0.05mol/L;
B、相当于在原来的基础上加入1.5mollSO2,抑制平衡向这反应方向移动,所以相同温度下达到平衡时,三氧化硫浓度大于0.05mol/L;
C、只存在反应物,平等向生成SO2的方向进行,达到平衡时,三氧化硫浓度小于0.05mol/L;
D、6molSO2和5molO2相当于6molSO3和2molO2,相当于在原来的基础上缩小体积,平衡向生成SO3的方向移动,则达到平衡时,三氧化硫浓度大于0.05mol/L;
因反应在相同温度下进行,则平衡常数相同,
故答案为:BD,等于;
(4)①因反应前后气体的计量数之和不相等,则体系内压强不再改变说明达到平衡状态;
②,因容器的体积不变,气体的总质量不变,则无论是否达到平衡状态,容器内气体的密度都不改变,不能用来判断是否达到平衡状态;
③反应前后气体的质量不变,如达到平衡状态,则混合气体的平均分子量不再改变,说明达到平衡状态;
④达到平衡时,正逆反应速率相等,V正(SO3)=2V逆(O2),说明达到平衡状态;
⑤因初始物质的物质的量没有明确,则n(SO3):n(O2):n(SO2)=2:1:2,不能作为判断是否达到平衡状态的依据,
故答案为:①③④.
| △c(SO3) |
| △T |
| 0.15mol/L-0.10mol/L |
| 4min |
(2)k=
| c(O2)×c2(SO2) |
| c2(SO3) |
| 0.1mol/L×(0.1mol/L)2 |
| (0.05mol/L)2 |
(3)A、因反应为可逆反应,2molSO2不可能完全转化为SO3,所以相同温度下达到平衡时,三氧化硫浓度小于0.05mol/L;
B、相当于在原来的基础上加入1.5mollSO2,抑制平衡向这反应方向移动,所以相同温度下达到平衡时,三氧化硫浓度大于0.05mol/L;
C、只存在反应物,平等向生成SO2的方向进行,达到平衡时,三氧化硫浓度小于0.05mol/L;
D、6molSO2和5molO2相当于6molSO3和2molO2,相当于在原来的基础上缩小体积,平衡向生成SO3的方向移动,则达到平衡时,三氧化硫浓度大于0.05mol/L;
因反应在相同温度下进行,则平衡常数相同,
故答案为:BD,等于;
(4)①因反应前后气体的计量数之和不相等,则体系内压强不再改变说明达到平衡状态;
②,因容器的体积不变,气体的总质量不变,则无论是否达到平衡状态,容器内气体的密度都不改变,不能用来判断是否达到平衡状态;
③反应前后气体的质量不变,如达到平衡状态,则混合气体的平均分子量不再改变,说明达到平衡状态;
④达到平衡时,正逆反应速率相等,V正(SO3)=2V逆(O2),说明达到平衡状态;
⑤因初始物质的物质的量没有明确,则n(SO3):n(O2):n(SO2)=2:1:2,不能作为判断是否达到平衡状态的依据,
故答案为:①③④.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
(6分)在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.09 mol·L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)=" a" mol·L-1。
(1)0min~4min内生成O2平均速率v(O2)= mol·L-1·min-1
(2)达到平衡时c(O2)=c(SO2),则a= mol·L-1,在下列坐标系中作出0min~8min及之后SO2、O2、SO3浓度随时间变化曲线.
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于a mol·L-1的是
| | A | B | C | D |
| SO3 | 1mol | 3mol | 3mol | 0mol |
| SO2 | 2mol | 1.5mol | 0mol | 6mol |
| O2 | 2mol | 1mol | 0mol | 5mol |
 在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.09mol?L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3):a mol?L-1.
在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.09mol?L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3):a mol?L-1.
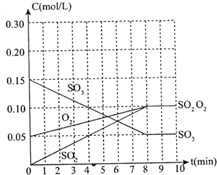 在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡.
在20L恒容的密闭容器中,加入3molSO3(g)和1mol氧气,在某温度下使其反应,反应至4min时,氧气的浓度为0.06mol/L,当反应到8min时,反应到达平衡.