题目内容
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) △H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应△H1、△H2、△H3的关系正确的是
| A.△H1>△H2>△H3 | B.△H1<△H3<△H2 | C.△H1<△H2<△H3 | D.△H1>△H3>△H2 |
D
解析试题分析:n(NaOH)= 0.5mol.①由于醋酸是弱酸,电离需要吸收热量,所以加入稀醋酸时放出的热量小于(1/2)×57.3kJ。即反应热△H1>△H。②浓硫酸溶解于水时放热,所以加入浓硫酸时放出热量大于(1/2)×57.3kJ。即△H2<△H。③稀硝酸在水中电离醋酸大量的氢离子。与强碱大量产生的氢氧根离子发生中和反应产生水,放出的热量等于(1/2)×57.3kJ。即△H3 =△H.所以△H1、△H2、△H3的关系正确的是△H1>△H3>△H2。选项为:D.
考点:考查中和热与电解质的强弱、浓度的关系的知识。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为( )
| A.-1 780 kJ/mol | B.-1 220 kJ/mol | C.-450 kJ/mol | D.+430 kJ/mol |
拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) 2NH3(g) ΔH=-92.4 kJ /mol,下列说法中正确的是
2NH3(g) ΔH=-92.4 kJ /mol,下列说法中正确的是
| A.H-H比N≡N更牢固 |
| B.N≡N键能约为946 kJ/mol |
| C.合成氨反应选择适当的催化剂是为了提高H2的转化率 |
| D.0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ |
下列说法正确的是
| A.吸热反应在常温下一定不能发生 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.已知C(石墨,s)=C(金刚石,s),△H1>0,说明石墨比金刚石稳定 |
D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的 不同 不同 |
合理利用燃料减小污染符合“绿色奥运”理念,下列关于燃料的说法正确的是( )
| A.“可燃冰”是将水变为油的新型燃料 |
| B.氢气是具有热值高、无污染等优点的燃料 |
| C.乙醇是比汽油更环保、不可再生的燃料 |
| D.石油和煤是工厂经常使用的可再生的化石燃料] |
下列热化学方程式书写正确的是
A.2SO2+O2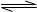 2SO3;ΔH =-196.6kJ/mol 2SO3;ΔH =-196.6kJ/mol |
| B.C(s)+O2(g)=CO2(g);ΔH =393.5kJ/mol |
| C.1/2H2(g)+1/2Cl2(g)=HCl(g);ΔH =-92.5kJ/mol |
| D.H+(aq)+OH-(aq)=H2O(l);ΔH =57.3kJ/mol |
下列热化学方程式中的ΔH能表示可燃物的燃烧热的是
| A.1/2H2(g)+1/2Cl2(g)=HCl(g);ΔH =-92.3kJ/mol |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH =-802.3kJ/mol |
| C.2H2(g)+O2(g)=2H2O(l);ΔH =-571.6kJ/mol |
| D.CO(g)+1/2O2(g)=CO2(g);ΔH =-283kJ/mol |
完全燃烧一定质量的无水乙醇,放出的热量为Q,为完全吸收生成的CO2,并使之生成正盐Na2CO3,消耗掉0.8mol/L NaOH溶液500mL,则燃烧1mol酒精放出的热量是
| A.0.2Q | B.0.1Q | C.5Q | D.10Q |
下列关于热化学反应的描述中正确的是( )
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |
| B.吸热反应一定需要加热才能发生 |
| C.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| D.CO燃烧热为283.0 kJ·mol-1,则2CO2(g) =2CO(g)+O2(g)的ΔH=+566.0 kJ·mol-1 |