��Ŀ����
����Ŀ��ˮ�ĵ���ƽ��������ͼ��ʾ��
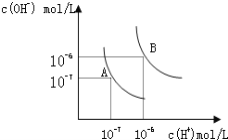
��1������A���ʾ25��ʱˮ�ڵ���ƽ��ʱ������Ũ�ȣ� ���¶�����100��ʱ��ˮ�ĵ���ƽ��״̬��B�㣬���ʱˮ�����ӻ���_____________���ӵ�_____________��
��2������100���ĺ��£���pH=8��Ba(OH)2��Һ��pH=5��ϡ�����ϣ���ʹ�����ҺpH=7����Ba(OH)2������������Ϊ____________________��
��3�����ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ�д�������Ӻ�������Ũ����ȣ����Ϻ���Һ��________�������������������������������������������____________����������Һ����������� >�� ������������<�� ����
��4����֪ij��Һ��ֻ����OH-��H+��NH4+��Cl-�������ӣ�ijͬѧ�Ʋ����Һ�и�����Ũ�ȴ�С˳��������������ֹ�ϵ��
A��c(Cl-)��c(NH4+)��c(H+)��c(OH-) B��c(Cl-)��c(NH4+)��c(OH-)��c(H+)
C��c(Cl-)��c(H+)��c(NH4+)��c(OH-) D��c(NH4+)��c(Cl-)��c(OH-)��c(H+)
������Һ��ֻ�ܽ���һ�����ʣ���������Ũ�ȴ�С��ϵ����ȷ���ǣ�ѡ����ĸ��________��
����������ϵ��D����ȷ�ģ�����Һ�е�����Ϊ____________________��
������ˮ�м���ϡ��������Һ��pH=7����ʱc(NH4+)=a mol/L����c(SO42-)= _____
���𰸡�10��14 10��12 2��9 ���� �� A NH3��H2O��NH4Cl a/2mol/L
��������
(1)A��25�棬c(H+)=c(OH-)=1��10-7mol/L��Kw=c(H+)c(OH-)=1��10-7��1��10-7=10-14��
100��ʱ��c(H+)=c(OH-)=1��10-6mol/L��Kw=c(H+)c(OH-)=1��10-6��1��10-6=10-12��
�ʴ�Ϊ��10-14��10-12��
(2)��pH=8��Ba(OH)2��Һ��c(OH-)=10-4 mol/L��pH=5��ϡ������c(H+)=10-5 mol/L�����������������Ϊx����������Ϊy�������Һ��pH=7����Һ�ʼ��ԣ�c(OH-)=![]() =10-5 mol/L��c(OH-)=
=10-5 mol/L��c(OH-)=![]() =10-5 mol/L����� x��y=2��9���ʴ�Ϊ��2��9��
=10-5 mol/L����� x��y=2��9���ʴ�Ϊ��2��9��
(3)���ʵ���Ũ����ͬ�Ĵ��������������Һ��Ϻ���Һ��c(Na+)=c(CH3COO-)�����ݵ���غ���c(H+)=c(OH-)����Һ�����ԣ���������Һ�ʼ��ԣ�Ҫʹ�����NaOH�����Һ�����ԣ�����Ӧ�������������Դ��������NaOH��Һ������ʴ�Ϊ�У����ԣ�����
(4)�����κ�ˮ��Һ�ж���OH-��H+��������ֻ��һ����ΪNH4Cl��笠�����ˮ�ⷽ��ʽΪNH4++H2ONH3��H2O+H+����c(Cl-)��c(NH4+)��ˮ�����Һ�����ԣ���c(H+)��c(OH-)����ˮ��ij̶Ⱥ�������c(Cl-)��c(NH4+)��c(H+)��c(OH-)����A���ϣ��ʴ�Ϊ��A��
����������ϵ��D����ȷ�ģ���Һ�ʼ��ԣ���c(NH4+)��c(Cl-)��ӦΪNH3H2O��NH4Cl�Ļ����ʴ�Ϊ��NH3H2O��NH4Cl��
�ۻ����Һ�����ԣ�����c(H+)=c(OH-)�����ݵ���غ��c(NH4+)+c(H+)=2c(SO42-)+c(OH-)������c(SO42-)=![]() c(NH4+)=
c(NH4+)=![]() amolL-1���ʴ�Ϊ��
amolL-1���ʴ�Ϊ��![]() amolL-1��
amolL-1��







