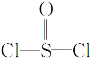��Ŀ����
����Ŀ����ˮ��ɽ���ǽ�ɽ�yɽ��������������Ⱦ��ĺ��������Ի�������������Ҫ���塣
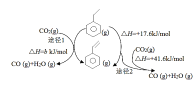
(1)����ijЩ�������ɹ�ʵ�ֽ������е�̼��������͵���������ת��Ϊ���Ĵ���ѭ�����ʡ�
��֪����![]()
![]()
��NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)
N2(g)+CO2(g)![]()
��2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]()
��Ӧ![]() ��
��![]() ________
________![]() ��ij�¶��£���Ӧ�٢ڢ۵�ƽ�ⳣ���քe��
��ij�¶��£���Ӧ�٢ڢ۵�ƽ�ⳣ���քe��![]() ��
��![]() ��
��![]() ����÷�Ӧ��K=________(��
����÷�Ӧ��K=________(��![]() ��
��![]() ��
��![]() ��ʾ)��
��ʾ)��
(2)�¶�Ϊ![]() �慼�����ĸ��ݻ���Ϊ1L�ĺ����ܱ������з�����Ӧ��
�慼�����ĸ��ݻ���Ϊ1L�ĺ����ܱ������з�����Ӧ��
![]()
![]() ������й�ʵ���������£�
������й�ʵ���������£�
������� | ���ʵ���ʼŨ��( | ���ʵ�ƽ��Ũ��( | |
|
|
| |
�� |
|
|
|
�� |
|
| |
�� |
|
| |
�� |
|
| |
��ƽ��ʱ�������������������ѹǿ֮��___________��
���¶Ȳ��䣬�������дﵽƽ����ٳ���NO��![]() (g)��
(g)��![]() mol����Ӧ����_____________��(����������������)������С�
mol����Ӧ����_____________��(����������������)������С�
(3)��������0.100![]() ����ֱ�ζ�10.00mLŨ�Ⱦ�Ϊ0.100
����ֱ�ζ�10.00mLŨ�Ⱦ�Ϊ0.100![]() ��NaOH��Һ�Ͷ��װ�[
��NaOH��Һ�Ͷ��װ�[![]() ]��Һ(��ˮ�е��뷽ʽ�백����)�������ô�������õζ���������Һ�ĵ絼����ͼ��ʾ����֪�������Һ�絼��Խ������Խǿ��
]��Һ(��ˮ�е��뷽ʽ�백����)�������ô�������õζ���������Һ�ĵ絼����ͼ��ʾ����֪�������Һ�絼��Խ������Խǿ��

��a��b��c��d�ĵ��ˮ��Һ�У���ˮ�����������Ũ�ȴ���![]()
![]() ����________________��ԭ��Ϊ_____________________��
����________________��ԭ��Ϊ_____________________��
�ڻ�ѧ��Ӧ����������ЧӦ��Ϊ������ϵa���¶�______________(����>������=������<��)c����¶ȡ�
���𰸡�-234.0 K2![]() 1��1 �� a ��ʱǡ������ǿ�������Σ���ˮ�ĵ����дٽ����� <
1��1 �� a ��ʱǡ������ǿ�������Σ���ˮ�ĵ����дٽ����� <
��������
��1�����ݸ�˹���ɽ��м��㣻
��2����������ʽ������ƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬ƽ�ⳣ�����䣬������ݽ������㣻
(3) ��NaOH����ǿ����װ���ˮ��Һ����������Һ�����ߢ�Ϊ�ζ����װ���Һ��ǿ�������Σ���ˮ�ĵ����дٽ����ã�
������кͷ�ӦΪ���ȷ�Ӧ�����װ��ĵ������ȣ���Ϊ������ϵa���¶�<c����¶ȡ�
��1����֪����![]()
![]()
��![]()
![]()
��![]()
![]()
���ݸ�˹���ɣ��ɢ�+����![]() -����
-����![]() �÷�Ӧ
�÷�Ӧ![]() ��
��![]() +
+![]() ��
��![]() -
-![]() ��
��![]() =-234.0
=-234.0![]() ���������Ϸ�Ӧ��֪��ij�¶��£���Ӧ�٢ڢ۵�ƽ�ⳣ���քeΪ
���������Ϸ�Ӧ��֪��ij�¶��£���Ӧ�٢ڢ۵�ƽ�ⳣ���քeΪ![]() ��
��![]() ��
��![]() ����÷�Ӧ��K=K2
����÷�Ӧ��K=K2![]() ��
��
��2�����º����£���ϵ��ѹǿ�ȵ�����������ʵ���֮�ȣ����ڷ�Ӧ���У�
2NO(g) + 2H2(g) ![]() N2(g) + 2H2O(g)
N2(g) + 2H2O(g)
��ʼ�� 6 2 0 0
��Ӧ�� x x 0.5x x
ƽ�⣺ 6-x 2-x 0.5x x
���ڷ�Ӧ���У�
2NO(g) + 2H2(g) ![]() N2(g) + 2H2O(g)
N2(g) + 2H2O(g)
��ʼ�� 2 6 0 0
��Ӧ�� y y 0.5y y
ƽ�⣺ 2-y 6-y 0.5y y �����ϵ�λ����10-3mol/L��
���¶���ͬ������Ӧ��ƽ�ⳣ����Ȼ��ȣ��г���ƽ�ⳣ������ʽK=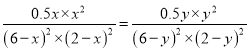 ��һ���õ�x=y����õ���ƽ��ʱ������Ӧ��ϵ�����������ʵ�����ȣ�����ѹǿ��ȣ���ƽ��ʱ�������������������ѹǿ֮��Ϊ1��1��
��һ���õ�x=y����õ���ƽ��ʱ������Ӧ��ϵ�����������ʵ�����ȣ�����ѹǿ��ȣ���ƽ��ʱ�������������������ѹǿ֮��Ϊ1��1��
�ڶ��ڷ�Ӧ���У�
2NO(g) + 2H2(g) ![]() N2(g) + 2H2O(g)
N2(g) + 2H2O(g)
��ʼ�� 0.006 0.001 0 0
��Ӧ�� 0.0004 0.0004 0.0002 0.0004
ƽ�⣺ 0.0056 0.0006 0.0002 0.0004
K=![]() =2.83��
=2.83��
����III��ʼ����NO��H2��Ũ������Ϊ1��10-3mol/L��6��10-3mol/L�����ݷ���ʽ���ص㣬�¶Ȳ��䣬���������������ƽ�ⳣ����ȣ�����III�ﵽƽ��ʱNO��H2��N2��H2O��g�������ʵ���Ũ������Ϊ0.0006mol/L��0.0056mol/L��0.0002mol/L��0.0004mol/L�����Գ���NO��H2O(g����2��10-4mol����Q=![]() =3.59>K���ʷ�Ӧ�����淴Ӧ������У�
=3.59>K���ʷ�Ӧ�����淴Ӧ������У�
(3) ��NaOH����ǿ����װ���ˮ��Һ����������Һ�����ߢ�Ϊ�ζ����װ���Һ������������������ˮ�ĵ��룬����ˮ��ٽ�ˮ�ĵ��룬�ζ��յ�ǰ��������ζ��յ���������ǡ����ȫ�ζ�ʱ�γ��Σ�NaCl����ˮ�⣬��(CH3��2NH2+��ˮ�⣬����10mL����ʱǡ����ȫ��Ӧ����ˣ�a��b��c��d�ĵ����Һ�У�a����ˮ�����������Ũ�ȴ���![]()
![]() ����Ϊ��ʱǡ������ǿ�������Σ���ˮ�ĵ����дٽ����ã�
����Ϊ��ʱǡ������ǿ�������Σ���ˮ�ĵ����дٽ����ã�
������кͷ�ӦΪ���ȷ�Ӧ�����װ��ĵ������ȣ���Ϊ������ϵa���¶�<c����¶ȡ�

 �ƸԴ��ž�ϵ�д�
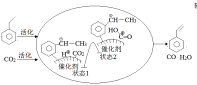
�ƸԴ��ž�ϵ�д�����Ŀ��Ŀǰȫ���������Ni��������������ͭ������Ǧ��п������ɫ��������λ���������ڸ��ָ߹���װ���������������Ҳ������������
��ʽ̼�������Ʊ���
��ҵ�õ������Һ����Ҫ��NiSO4��NiCl2�ȣ��Ʊ���ʽ̼��������[xNiCO3��yNi(OH)2��zH2O]���Ʊ�������ͼ��
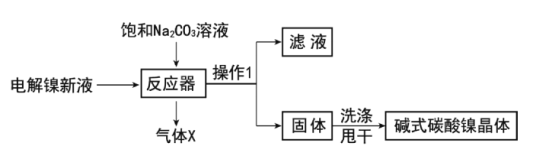
��1����Ӧ���е�һ����Ҫ��ӦΪ3NiSO4+3Na2CO3+2H2O=NiCO3��2Ni(OH)2+3Na2SO4+2X��X�Ļ�ѧʽΪ__��
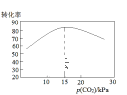
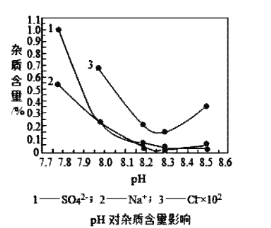
��2�������ڷ�Ӧ���з�Ӧʱ��Ҫ���Ʒ�Ӧ�¶Ⱥ�pHֵ��������ͼ����Ӧ�������ʺϵ�pHֵΪ__��
��3�������ʽ̼��������ϴ�Ӹɾ��ķ�����__��
�ⶨ��ʽ̼�����������ɣ�
Ϊ�ⶨ��ʽ̼��������[xNiCO3��yNi(OH)2��zH2O]��ɣ�ijС���������ͼʵ�鷽����װ�ã�
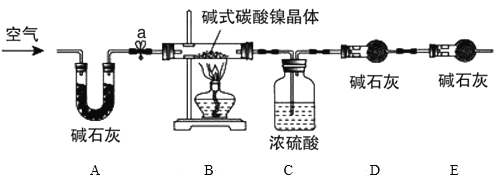
���Ͽ�Ƭ����ʽ̼�����������Ȼ���ȫ�ֽ�����NiO��CO2��H2O
ʵ�鲽�裺
�ټ��װ�������ԣ�
��ȷ����3.77g��ʽ̼��������[xNiCO3��yNi(OH)2��zH2O]����Bװ���У�����������
�۴��ɼ�a������һ��ʱ��������ֱ����װ��C��D��E����������¼��
��__��
�ݴ��ɼ�a��������һ��ʱ�������
�ֱ�ȷ����װ��C��D��E����������¼��
�߸������ݽ��м��㣨����������±���
װ��C/g | װ��D/g | װ��E/g | |
����ǰ | 250.00 | 190.00 | 190.00 |
���Ⱥ� | 251.08 | 190.44 | 190.00 |
ʵ����������ݴ�����
��4��Eװ�õ�����__��
��5������ܵ�ʵ�����___��
��6��ͨ������õ���ʽ̼������������__���ѧʽ����
�����Ʊ���
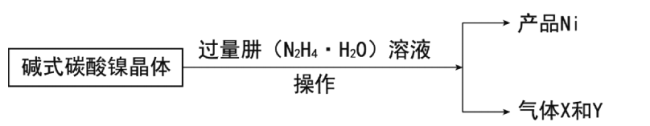
��7��д���Ʊ�Ni�Ļ�ѧ����ʽ__��