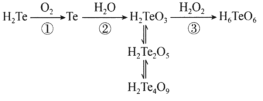
题目内容
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,1LC2H5OH完全燃烧后生成的CO2分子个数约为![]()
B.20gD2O与20gH218O含有的中子数均为10NA
C.1mol·L-1Al(NO3)3溶液中含有3NA个NO3-
D.50mL12mol·L-1盐酸与足量MnO2共热,转移的电子数为0.3NA
【答案】B
【解析】
A选项,标准状况下乙醇为液体,不能用气体摩尔体积来计算,故A错误;
B选项,D2O与H218O的摩尔质量均为20g·mol-1,故20gD2O与20gH218O的物质的量均为1mol,且它们每个分子中均含10个中子,故1mol两者中均含10NA个中子,故B正确;
C选项,溶液体积未知,无法计算离子个数,故C错误;
D选项,50mL12mol·L-1盐酸与足量MnO2共热反应一段时间后,盐酸浓度减小,无法继续反应,转移电子数目小于0.3NA,故D错误。
综上所述,答案为B。

 教学练新同步练习系列答案
教学练新同步练习系列答案【题目】某实验小组研究KI和酸性KMnO4溶液的反应。
实验序号 | Ⅰ | Ⅱ |
实验操作 |
|
|
实验现象 | 紫色褪去,溶液变为棕黄色 | 紫色溶液迅速变为棕褐色悬浊液,然后沉淀消失,溶液变为棕黄色 |
资料:i. MnO4— 在酸性条件下最终被还原为Mn2+。ii. 酸性条件下氧化性: KMnO4>KIO3>I2 。
(1)实验1中溶液呈棕黄色,推测生成了________。
(2)实验小组继续对实验II反应中初始阶段的产物成分进行探究:

①经检验,实验II初始阶段I— 的氧化产物不是I2,则“实验现象a”为________。
②黑色固体是________。
③设计实验方案证明在“紫色清液”中存在IO3-:________。
④写出生成IO3-的离子方程式:________。
(3)探究实验II中棕褐色沉淀消失的原因。

用离子方程式解释实验II中棕褐色沉淀消失的原因:________。
(4)实验反思:KI和酸性KMnO4溶液反应过程中,所得产物成分与________有关(写出两点即可)。
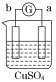
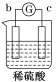
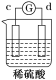
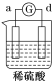
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小 b极质量增加 | 溶液中的H+向c极移动 | d极溶解 c极有气体产生 | 电流从a极流出 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>a
C.d>a>b>cD.a>b>d>c