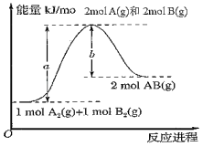
题目内容
【题目】有A、B、C、D、E、F七种元素,试按如下所给的条件推断:
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大,且原子半径:A>B>C;
②D、E是非金属元素,它们与氢化合可生成气态氢化物HD和H2E,室温下,D的单质是黄绿气体,E的单质是淡黄色固体;
③F是非金属性最强的元素
(1)A在加热条件下生成的氧化物的电子式为___,含有的化学键类型有___,D在元素周期表的位置是___。
(2)用电子式表示B、D元素形成的化合物的形成过程:___。
(3)比较D和E的氢化物稳定性强弱:___(填化学式)。D、E、F简单离子半径由大到小为___(填离子符号)。
(4)C的最高价氧化物对于的水化物的化学式为___;和A的最高价氧化物对应的水化物反应的离子方程式为___。
【答案】![]() 离子键和共价键 第三周期第ⅦA族
离子键和共价键 第三周期第ⅦA族 ![]() HCl>H2S S2->Cl->F- Al(OH)3 Al(OH)3+OH-=
HCl>H2S S2->Cl->F- Al(OH)3 Al(OH)3+OH-=![]() +2H2O
+2H2O
【解析】
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,即处于第三周期,A的原子半径在所属周期中最大且原子半径A>B>C,可推知A为Na,B为Mg,C为Al;
②D、E是非金属元素,它们与氢化合可生成气态氢化物HD和H2E,D、E分别表现-1、-2价,室温下,D的单质是黄绿气体,E的单质是淡黄色固体,则D为Cl元素,E为S元素;
③F是非金属性最强的元素,周期表中最右上角的元素非金属最强,即F是F元素;故A、B、C、D、E、F分别为:Na、Mg、Al、Cl、S、F。
(1) A在加热条件下生成的氧化物是Na2O2,电子式为:![]() ;含有的化学键类型:离子键和共价键;D是Cl元素,在元素周期表的位置是:第三周期第ⅦA族;
;含有的化学键类型:离子键和共价键;D是Cl元素,在元素周期表的位置是:第三周期第ⅦA族;
(2) B、D元素形成的化合物是MgCl2,用电子式表示形成过程:![]() ;
;
(3) D、E分别为Cl、S,同周期从左到右,非金属性增强,则Cl>S,氢化物稳定性越稳定,故HCl>H2S;同周期的简单离子半径随原子序数的增大而减小,随电子层数大的离子半径大,即:S2->Cl->F-,故答案为:HCl>H2S;S2->Cl->F-;
(4) C是Al,其最高价氧化物对于的水化物的化学式为:Al(OH)3;A的最高价氧化物对应的水化物为NaOH,两者反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O,离子方程式为:Al(OH)3+OH-=![]() +2H2O
+2H2O

 阅读快车系列答案
阅读快车系列答案