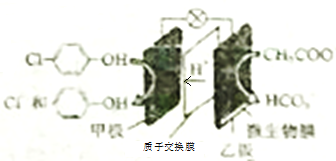
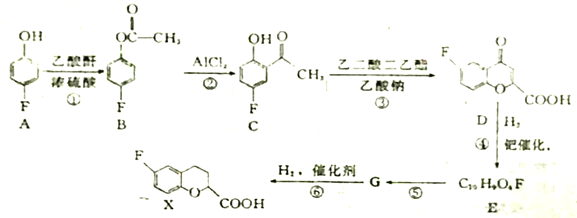
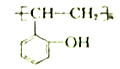
题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
B. 标准状况下,2.24LSO3中所含原子数为0.4 NA
C. 常温常压下,16gO2和O3的混合气体中所含原子数目为NA
D. 在一定条件下lmolN2与3molH2反应生成的NH3分子数为2NA
【答案】C
【解析】A项,常温下Al在浓硫酸中发生钝化,A项错误;B项,标准状况下SO3呈固态,无法用22.4L/mol计算SO3物质的量,B项错误;C项,O2和O3互为同素异形体,16gO2和O3的混合气体中所含O原子物质的量:n(O)=![]() =1mol,C项正确;D项,N2与H2化合成NH3的反应为可逆反应,在一定条件下1molN2与3molH2反应生成NH3分子物质的量小于2mol,D项错误;答案选C。
=1mol,C项正确;D项,N2与H2化合成NH3的反应为可逆反应,在一定条件下1molN2与3molH2反应生成NH3分子物质的量小于2mol,D项错误;答案选C。

练习册系列答案
相关题目