题目内容
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:
HXO4>H2YO4>H3ZO4,则下列判断中正确的是
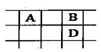
| A.元素非金属性按X、Y、Z的顺序减弱 |
| B.原子的电子能力按X、Y、Z的顺序增强 |
| C.气态氢化物的稳定性按X、Y、Z的顺序增强 |
| D.单质的氧化性按X、Y、Z的顺序增强 |
A
解析试题分析:由同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序HXO4>H2YO4>H3ZO4可得X、Y、Z在元素周期表中的位置为Z、Y、X,可假设分别为P、S、Cl;A、非金属性从左向右逐渐增强,得电子能力逐渐增强,故A正确,B错误;气态氢化物的稳定性从左向右逐渐增强,故C错误;D、非金属性强,单质的氧化性就强,故D错误;故选A。
考点:同周期性质的递变规律。

练习册系列答案
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
人类探测月球发现,在月球的土壤中含有较丰富的质量数为3的氦,它可以作为未来核聚变的重要原料之一。氦的该种同位素应表示为
A. He He | B. He He | C. He He | D.He |
X、Y、Z、W是元素周期表前四周期中的常见元素。其相关信息如下表:
| 元素 | 相关信息 |
| X | X的一种核素的质量数为14,中子数为8 |
| Y | Y与X同周期,且它的一种氧化物只能用排水法收集 |
| Z | Z的单质常温下为黄绿色气体 |
| W | W的原子核外电子总数是其电子层数的4倍 |
A.原子半径:W> X>Y,离子半径:W>Z
B.氧化物对应的水化物的酸性:Z> Y>X
C.Y的最高正价含氧酸,可由它的氢化物为原料来制取
D.W的单质与X的一种氧化物不能发生置换反应
元素的性质随着元素原子序数的递增而呈周期性变化的原因是
| A.元素原子的核外电子排布呈周期性变化 |
| B.元素的原子半径呈周期性变化 |
| C.元素的化合价呈周期性变化 |
| D.元素的金属性、非金属性呈周期性变化 |
下列判断中一定正确的是
| A.若X、Y都是气态氢化物,且相对分子质量:X﹥Y,则沸点:X﹥Y |
| B.若X、Y属于同主族元素,且相对原子质量:X﹥Y,则X的失电子能力比Y强 |
| C.若R2-和M+的电子层结构相同,则原子序数:R﹥M |
| D.若M、N是同主族元素,且原子序数:M﹥N,则非金属性:M﹥N |
下列说法中,正确的是 ( )
| A.H35Cl、H37Cl属于同素异形体 |
| B.16O与18O的中子数不同,核外电子排布却相同 |
| C.稳定性:CH4>SiH4;还原性:HCl>H2S |
| D.K+、Ca2+、Mg2+的离子半径依次增大,还原性依次增强 |
下列事实一般不能用于判断金属性强弱的是( )
| A.金属的颜色和熔沸点 |
| B.金属元素的最高价氧化物对应的水化物的碱性强弱 |
| C.1mo金属单质在反应中失去电子的多少 |
| D.金属元素的单质和水或酸置换出氢的难易 |
核反应堆通常使用235U和239Pu作为原料,研究和开发核能可以减少对化石燃料的依赖。下列有关说法正确的是
| A.239Pu比235U原子核内多4个中子 |
| B.核反应堆中使用的重水与水互为同位素 |
| C.石油、天然气等化石燃料属于可再生能源 |
| D.合理使用核能可有效减少温室气体的排放 |