题目内容
17. 减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
减少氮的氧化物在大气中的排放是环境保护的重要内容之一.(1)如图是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g) 的△H=-760.3kJ•mol-1
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如下表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有D
A.升高温度 B.恒容充入氦气 C.恒容再充入NO2 D.把恒容改为恒压,其它条件相同.
分析 (1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,可得热化学方程式:
NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1 ①
又已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1②
根据盖斯定律,2×①-②可得:2NO(g)+2CO(g)?N2(g)+2CO2(g),反应热也进行相应计算;
(2)①已知K(300℃)>K(350℃),说明降低温度平衡正向移动,而降低温度平衡向放热反应方向移动;
②转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;若要增大NO2的转化率,应改变条件使平衡正向移动,但不能只增大NO2的用量,否则其转化率会降低.
解答 解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368-134=234kJ,可得热化学方程式:
NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ•mol-1 ①
又已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1②
根据盖斯定律,2×①-②可得:2NO(g)+2CO(g)?N2(g)+2CO2(g),△H=(-234kJ/mol)×2-(+292.3kJ•mol-1)=-760.3kJ•mol-1,
故答案为:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;-760.3kJ•mol-1;
(2)①已知:K(300℃)>K(350℃),说明降低温度平衡正向移动,而降低温度平衡向放热反应方向移动,故该反应为放热反应,
故答案为:放热;
②1000s时处于平衡状态,平衡时转化的二氧化氮为(20-10.08)mol=9.92mol,故二氧化氮的转化率=$\frac{9.92mol}{20mol}$×100%=49.6;
A.该反应的正反应是放热反应,升高温度平衡逆向移动,二氧化氮转化率减小,故A错误;
B.恒容充入氦气,使体系压强增大,但反应体系中各物质浓度不变,平衡不移动,所以二氧化氮转化率不变,故B错误;
C.恒容再充入NO2,平衡正向移动,但转化率降低,故C错误;
D.把恒容改为恒压,其它条件相同,与恒容相比增大压强,平衡正向移动,二氧化氮转化率增大,故D正确;
故答案为:49.6%;D.
点评 本题考查化学平衡计算与影响因素、热化学方程式及反应热计算,注意平衡常数只受温度影响,平衡常数及其单位与方程式中化学计量数有关,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 用K37ClO3与浓盐酸反应制氯气:K37ClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$K37Cl+3Cl2+3H2O | |
| C. | 足量小苏打溶液与氢氧化钡溶液混合:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| D. | 向AlCl溶液中滴加过量的氨水:Al3++4OH-═[Al(OH)4]- |
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正) | |
| C. | 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol气体Y,到达平衡时,n(Z)=0.24 mol | |
| D. | 其他条件不变,向平衡体系中再充入0.16 mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大 |
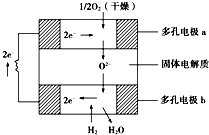 固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )
固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过.该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应.下列判断正确的是( )| A. | 有O2参加反应的a极为电池的负极 | |
| B. | 电路中每转移2mole-,则消耗H2的体积为22.4L. | |
| C. | a极对应的电极反应式为O2+2H2O+4e-═4OH- | |
| D. | 该电池的总反应式为2H2+O2$\frac{\underline{\;高温\;}}{\;}$2H2O |
| A. | Cu2+ | B. | Fe3+ | C. | Fe2+ | D. | H+ |
| A. | 都产生白烟 | B. | 都发生爆炸 | C. | 都产生黄色火焰 | D. | 都生成白色固体 |
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题:
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.请回答下列问题: