题目内容
10.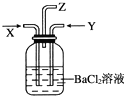 X气体为SO2和CO2的混合气体,Y气体为Cl2,它们同时通入盛有足量氯化钡溶液的洗气瓶中(如下图所示装置).下列说法正确的是( )
X气体为SO2和CO2的混合气体,Y气体为Cl2,它们同时通入盛有足量氯化钡溶液的洗气瓶中(如下图所示装置).下列说法正确的是( )| A. | 洗气瓶中产生的沉淀是亚硫酸钡 | B. | 洗气瓶中产生的沉淀是碳酸钡 | ||
| C. | 洗气瓶中没有明显现象 | D. | 洗气瓶中有硫酸钡沉淀 |
分析 二氧化硫具有还原性,与氯气在水中发生反应离子方程式:SO2+Cl2+2H2O═4H++2Cl-+SO42-,生成的硫酸根离子能够与氯化钡反应生成硫酸钡沉淀;
碳酸酸性弱于盐酸,二氧化碳通入氯化钡溶液,不会发生反应,据此分析解答.
解答 解:二氧化硫具有还原性,与氯气在水中发生反应离子方程式:SO2+Cl2+2H2O═4H++2Cl-+SO42-,生成的硫酸根离子能够与氯化钡反应生成硫酸钡沉淀;
碳酸酸性弱于盐酸,二氧化碳通入氯化钡溶液,不会发生反应,所以不会生成碳酸钡沉淀,洗气瓶中的沉淀为硫酸钡沉淀,
故选:D.
点评 本题考查了元素化合物性质,熟悉二氧化硫和氯气的性质及发生的反应是解题关键,注意相关元素化合物知识的积累.

练习册系列答案
相关题目
20.关于食物的酸碱性说法不正确的是( )
| A. | 葡萄吃起来是酸的,故它属于酸性食物 | |
| B. | 正常人的人体内体液pH总保持恒定 | |
| C. | 食物的酸碱性与化学上所指溶液的酸碱性不同的 | |
| D. | 蛋白质在体内经消化后生成碳酸、硫酸、尿酸等,故它属于酸性食物 |
1.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2.7g金属铝变成铝离子时失去的电子数目为0.2NA | |
| B. | 16g CH4与18 g NH4+ 所含质子数相等 | |
| C. | 标准状况下,22.4 L汽油所含的分子数为NA | |
| D. | 在0℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
18.关于亚硝酸钠与氯化钠,下列叙述正确的是( )
| A. | 因亚硝酸钠有剧毒,所以不能用作食品添加剂 | |
| B. | 可用淀粉-KI试纸来鉴别一种盐溶液是亚硝酸钠还是氯化钠 | |
| C. | 能用硝酸银溶液来区别亚硝酸钠与氯化钠 | |
| D. | 因NaNO2具有较强的氧化性,可用酸性KMnO4溶液和FeCl2溶液鉴别NaCl与NaNO2 |
15.下列离子或化学方程式与所述事实相符且正确的是( )
| A. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| B. | 用K37ClO3与浓盐酸反应制氯气:K37ClO3+6HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$K37Cl+3Cl2+3H2O | |
| C. | 足量小苏打溶液与氢氧化钡溶液混合:Ba2++OH-+HCO3-═BaCO3↓+H2O | |
| D. | 向AlCl溶液中滴加过量的氨水:Al3++4OH-═[Al(OH)4]- |
2.有关下列装置图的叙述正确的是( )


| A. | 若X为粗铜,Y为硫酸铜,K接N,则此装置可以精炼铜 | |
| B. | 若X为铜,Y为浓硝酸,K接M,可以形成原电池,则铁为负极 | |
| C. | 若X为锌,则无论K接M还是N,铁都能被保护 | |
| D. | 若X为银,Y为FeCl3,K接N,则此装置可以在铁上镀银 |