题目内容
【题目】室温时,体积为1mL、浓度均为0.1mol·L-1的两种常见物质X(OH)n、K2AO3的溶液分別加水稀释至体积为VmL,pH随lgV的变化情况如下图所示。下列叙述错误的是( )
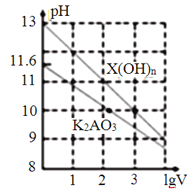
A. n=1
B. H2AO3的二级电离常数Ka2约为1.0×10-10.2
C. pH=10的两种溶液中水的电离程度相同
D. 升高温度,K2AO3溶液pH增大,X(OH)n溶液pH减小
【答案】C
【解析】A、0.1mol·L-1的X(OH)n的pH=13,因此推出n=1,故A说法正确;B、0.1mol·L-1K2AO3的pH=11.6,根据水解平衡常数的表达式,得出Kh= =10-3.8,根据Kw=Kh×Ka,得出Ka2=1.0×10-10.2,故B说法正确;C、X(OH)n属于碱,抑制水的电离,K2AO3属于强碱弱酸盐,AO32-发生水解,促进水的电离,故C说法错误;D、升高温度,促进盐类水解,c(OH-)增大,因此K2AO3溶液的pH增大,升高温度水的离子积增大,X(OH)n属于强碱,因此pH减小,故D说法正确。
=10-3.8,根据Kw=Kh×Ka,得出Ka2=1.0×10-10.2,故B说法正确;C、X(OH)n属于碱,抑制水的电离,K2AO3属于强碱弱酸盐,AO32-发生水解,促进水的电离,故C说法错误;D、升高温度,促进盐类水解,c(OH-)增大,因此K2AO3溶液的pH增大,升高温度水的离子积增大,X(OH)n属于强碱,因此pH减小,故D说法正确。

练习册系列答案
相关题目