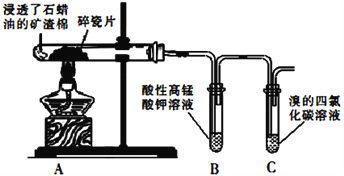
题目内容
【题目】阿伏加德罗常数的值为NA,下列说法正确的是
A. 标准状况下,4.6gNO2和N2O4的混合气体中原子数为0.3NA
B. 1mol 乙烯分子中含有的共价键数为4NA
C. 0.1mol·L-1的硫酸溶液中含H+的数量为0.2NA
D. 氢氧燃料电池中消耗11.2L氢气时转移电子数为NA
【答案】A
【解析】A. 4.6gNO2的物质的量为0.1mol,其中含0.3mol原子;4.6g N2O4的物质的量为0.05mol,其中含0.3mol原子。 所以, 4.6gNO2和N2O4的混合气体中原子数为0.3NA,A正确;B. 乙烯分子中有6个共价键(5个![]() 键、1个键
键、1个键![]() ),所以1mol 乙烯分子中含有的共价键数为6NA,B不正确;C. 不知道溶液的体积,无法计算0.1mol·L-1的硫酸溶液中所含H+的数量,C不正确;D. 没有注明是否为标准状况,无法计算11.2L氢气的物质的量,所以无法计算氢氧燃料电池中消耗11.2L氢气时转移的电子数,D不正确。本题选A。
),所以1mol 乙烯分子中含有的共价键数为6NA,B不正确;C. 不知道溶液的体积,无法计算0.1mol·L-1的硫酸溶液中所含H+的数量,C不正确;D. 没有注明是否为标准状况,无法计算11.2L氢气的物质的量,所以无法计算氢氧燃料电池中消耗11.2L氢气时转移的电子数,D不正确。本题选A。

【题目】氢能是一种极具发展潜力的清洁能源。
(1)氢气的制取与储存是氢能源利用领域的研究热点.
已知:①CH4的燃烧热为890KJ·mol-1; ②H2的热值为50.2kJ·g-1
则甲烷部分氧化生成CO2和H2的热化学方程式为___________________________________;该反应自发进行的条件是___________。
(2)Bodensteins研究了如下反应:2HI(g)![]() H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1.00 | 0.910 | 0.850 | 0.815 | 0.795 | 0.784 |
X(HI) | 0.00 | 0.600 | 0.730 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00min-1,在t=20min时,v逆=__________min-1(保留三位有效数字)
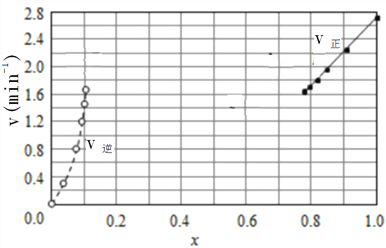
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。______________
(3)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________。