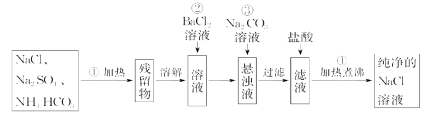
题目内容
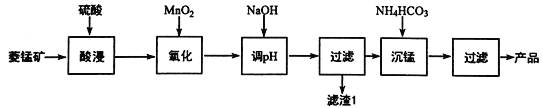
【题目】以某菱锰矿(含MnCO3、SiO2、FeCO3和少量Al2O3等)为原料通过以下方法可获得碳酸锰粗产品:
(1)“酸浸”时加快反应速率的方法除了增加硫酸的浓度和加热外,还有___________________。(写出一种)
(2)在加NaOH调节溶液的pH时约为5,如果pH过大,可能导致滤渣1中 ___________________(填化学式)的含量减少。
(3)取“沉锰”前溶液a mL于锥形瓶中,加入少量AgNO3溶液(作催化剂)和过量的1.5%(NH4)2S2O8(过二硫酸氨)溶液,加热,Mn2+被氧化为MnO4-,反应一段时间后再煮沸5 min[除去过量的(NH4)2S2O8],冷却至室温。选用适宜的指示剂,用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定至终点,平均消耗(NH4)2Fe(SO4)2标准溶液的体积为V mL。
①Mn2+与(NH4)2S2O8反应的离子方程式为___________________________________________。
②用含a、b、V的代数式表示“沉锰”前溶液中c(Mn2+)=_______________。
(4)①写出“沉锰”时的离子方程式:___________________________________________。
②在其他条件相同时,NH4HCO3的初始浓度越大,锰元素回收率越高,请从沉淀溶解平衡的角度解释其原因___________________________________________。
【答案】 将矿石粉碎(或搅拌等) Al(OH)3、SiO2 2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+ ![]() molL-1 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O c(NH4HCO3)越大,c(CO32-)越大,使平衡MnCO3(s)
molL-1 Mn2++2HCO3-=MnCO3↓+CO2↑+H2O c(NH4HCO3)越大,c(CO32-)越大,使平衡MnCO3(s)![]() CO32- (aq)+Mn2+ (aq)向逆反应方向移动,析出的MnCO3越多(或其他合理解释)
CO32- (aq)+Mn2+ (aq)向逆反应方向移动,析出的MnCO3越多(或其他合理解释)
【解析】此化工流程是制备碳酸锰的。第一步是目标元素提取,菱锰矿用硫酸浸取得硫酸锰溶液,同时碳酸亚铁和氧化铝也溶了生成硫酸亚铁和硫酸铝,第二步是用二氧化锰将亚铁离子氧化为+3价铁离子,第三步是加氢氧化钠调pH将+3价铁离子和+3价铝离子转化为氢氧化物沉淀,经过滤后,向滤液中加入碳酸氢铵沉锰得到碳酸锰。
(1)“酸浸”时加快反应速率的方法除了增加硫酸的浓度和加热外,还有将矿石粉碎(或搅拌等) 。
(2)在加NaOH调节溶液的pH时约为5,如果pH过大,可能导致滤渣1中Al(OH)3、SiO2 的含量减少,这两种物质都可以与强碱反应生成可溶性盐。
(3)①Mn2+与(NH4)2S2O8反应的离子方程式为2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+ 。②用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定时发生的反应为
2MnO4-+10SO42-+16H+ 。②用b mol·L-1的(NH4)2Fe(SO4)2标准溶液滴定时发生的反应为
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,由于反应前后锰元素守恒,所以n(Mn2+)=![]() n(Fe2+)=
n(Fe2+)=![]()
![]() V
V![]() ,所以 “沉锰”前溶液中c(Mn2+)=
,所以 “沉锰”前溶液中c(Mn2+)= ![]() molL-1 。
molL-1 。
(4)①写出“沉锰”时的离子方程式:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O。
②在其他条件相同时,NH4HCO3的初始浓度越大,锰元素回收率越高,其原因为c(NH4HCO3)越大,c(CO32-)越大,对平衡MnCO3(s)![]() CO32- (aq)+Mn2+ (aq)向沉淀方向移动越有利,析出的MnCO3越多。
CO32- (aq)+Mn2+ (aq)向沉淀方向移动越有利,析出的MnCO3越多。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案