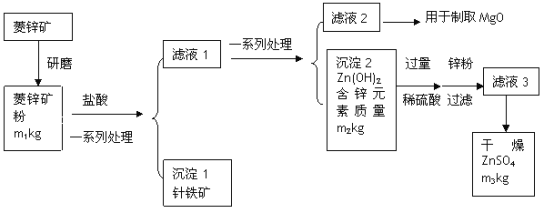
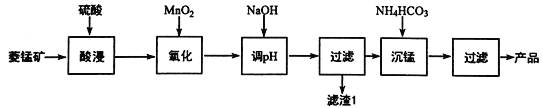
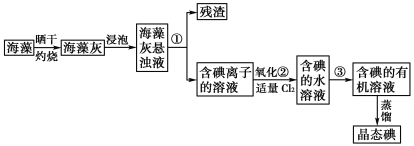
题目内容
【题目】已知:25℃时,电离常数Kb(NH3·H2O)=1.8×l0-5,CH3COOH的电离常数与其相等。现向1 L 0.1 molL-1氨水中加入等体积的0.1 molL-1CH3COOH溶液,则下列说法正确的是
A. 在滴加过程中,Kw始终保持不变
B. 25℃时,反应后溶液中 c(NH4+)>c(CH3COO-)
C. 若用氨水标准溶液滴定盐酸,则应选择酚酞作为指示剂
D. 25℃时,反应NH4++H2O![]() NH3H2O+H+的平衡常数约为 5.6 ×10-10
NH3H2O+H+的平衡常数约为 5.6 ×10-10
【答案】D
【解析】A. 酸碱中和反应是放热反应,在滴加过程中溶液的温度会升高,而水的电离是吸热的,所以Kw增大,A不正确;B. 25℃时,因为两者的电离常数相等,所以反应后所得醋酸铵溶液中醋酸根离子和铵根的水解程度也是相同的,所以溶液中 c(NH4+)=c(CH3COO-),B不正确;C. 指示剂是根据滴定终点的酸碱性选择的,若用氨水标准溶液滴定盐酸,由于滴定终点为酸性(生成的氯化锭水解显酸性),则应选择突变范围在酸性的甲基橙作为指示剂,所以C不正确;D. 25℃时,反应NH4++H2O![]() NH3H2O+H+的平衡常数约为
NH3H2O+H+的平衡常数约为 =
=  =
= ![]() =
=![]() = 5.6 ×10-10,所以D正确。
= 5.6 ×10-10,所以D正确。

练习册系列答案
相关题目