题目内容
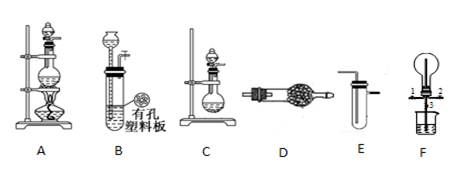
单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气还原可得
高纯硅。以下是实验室制备四氯化硅的装置示意图。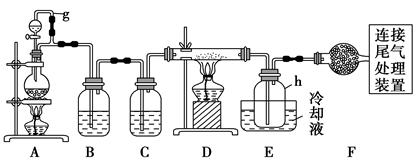
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | - | 315 | - |
| 熔点/℃ | -70.0 | -107.2 | - | - | - |
| 升华温度/℃ | - | - | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式: 。
(2)装置A中g管的作用是 ;装置C中的试剂是 ;装置E中的h瓶需要冷却的理由是 。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(1)MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(2)平衡气压 浓H2SO4 SiCl4沸点较低,用冷却液冷却可得到液态SiCl4
(3)Al、B、P
解析

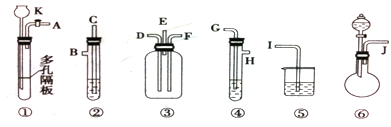
(18分) (1)某实验小组的甲同学用图l所示装置制取少量乙酸乙酯(加热设备及夹持固定装置均略去)。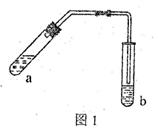

①试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是 。
②试管a中加入碎瓷片的作用是 ,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是 (填序号)。
| A.立即补加 | B.不需补加 | C.冷却后补加 | D.重新配料 |
④试管b中盛有饱和Na2CO3溶液,其作用是 。
⑤反应结束后,振荡试管b,静置。观察到的现象是 。
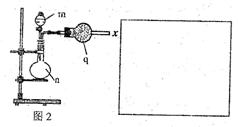
(2)该小组的乙同学利用图2所示装置制备并收集干燥的NO2气体。
①图2中仪器n的名称是 。
②请在方框内画出用集气瓶收集NO2的装置图。
③写出仪器n中发生反应的离子方程式: 。
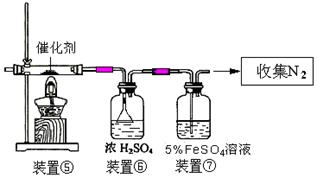
(3)该小组的丙同学利用图2所示装置制取NH3和O2的混合气体,并且利用图3所示装置验证NH3的某些性质。m中加入浓氨水,q中加入碱石灰,e内放置催化剂(铂石棉),按气流方向连接各仪器x→y→z→h。
①图2仪器n内需加入固体试剂的名称为 。
②实验中观察到e内有红棕色气体出现,证明氨气具有 性,e中发生反应的化学方程式为 。
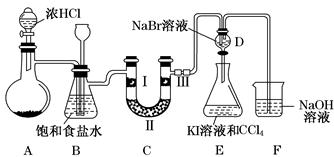
(18分)实验室常用下列装置制备、收集二氧化氮气体,并探究其性质。
(1)装置A中的分液漏斗里盛装的液体通常是 ,圆底烧瓶中预先加入的是铜片,但铁的价格比铜的价格低,此处用铜片不用铁片的原因是 。
(2)干燥管D中装的干燥剂是无水氯化钙,其作用是 。
(3)随着时间的推移,浓硝酸逐渐变稀,装置E的作用是吸收尾气,吸收过程中发生反应的化学方程式如下:2NO2+2NaOH=NaNO3+NaNO2+H2O ;NO2+NO+2NaOH=2NaNO2+H2O
①NO和NO2混合气体的组成可表示成NOx,该混合气体通入NaOH溶液被完全吸收时,x的值可以为 (填字母)
| A.1.1 | B.1.2 | C.1.5 | D.1.8 |
(4)在上述装置中,若改用其它收集装置,最后收集到的气体中无NO2气体,则采用的收集装置是 (选填“F”或 “G”)。
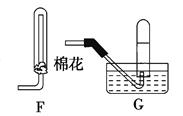
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。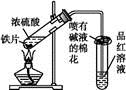
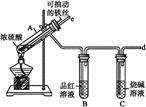
图1 图2
(1)比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
② 。(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而污染环境;二是 。(3)能说明有SO2气体产生的实验现象是 。(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀H2SO4溶液 |
| C.KSCN溶液 | D.KMnO4溶液 |
G.H2O2溶液