题目内容
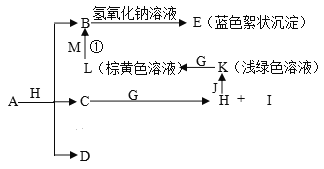
【题目】已知X、Y、Z三元素的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。C、D是由X、Y、Z中两种元素组成的化合物,C通常状况下为无色液体, D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。各物质之间的转换关系如下图,部分生成物省略。请回答下列问题:
(1)写出A的化学式__________________,C的电子式______________________,
D的结构式______________________________。
(2)将22.4L(标准状况)D气体通入1L 1mol/L NaOH溶液中,完全吸收后,溶液中除了Na+外,还大量存在的离子是______________________________。
(3)已知M溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的离子方程式___________________________________________________________。
(4)检验化合物K中阳离子的实验方法是______________________________________
(5)写出反应K+G→L的化学方程式是________________________________________。
【答案】 CuCO3或Cu2(OH)2CO3 ![]() O=C=O HCO3- 3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O 向待测溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变红,说明有Fe2+存在 2Fe2++Cl2===2Fe3++2Cl-
O=C=O HCO3- 3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O 向待测溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变红,说明有Fe2+存在 2Fe2++Cl2===2Fe3++2Cl-
【解析】X在周期表中的原子半径最小,则X为H元素;Y、Z原子最外层电子数之和为10,X、Y、Z的原子序数依次增大,C、D是由X、Y、Z中两种元素组成的化合物,D为无色非可燃性气体,考虑Y、Z为C、O两种元素,C通常状况下为无色液体,则D为CO2,C为H2O;G为黄绿色单质气体,则G应为Cl2,由C+G→H+I,可以知道生成HCl和HClO,I有漂白作用,应为HClO,则H为HCl,浅绿色、棕黄色溶液为Fe2+和Fe3+,可以知道J为Fe,K为FeCl2,L为FeCl3,反应①用于制作印刷电路板为FeCl3和Cu,则M为Cu,B为CuCl2,B与氢氧化钠反应生成蓝色絮状沉淀,则E为Cu(OH)2,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可以知道,A是含有Cu2+的碳酸盐,应为CuCO3或Cu2(OH)2CO3。
(1)根据上面的分析可以知道,A为CuCO3或Cu2(OH)2CO3,C为H2O,C的电子式为![]() ,D为CO2,D的结构式为O=C=O;正确答案:CuCO3或Cu2(OH)2CO3;
,D为CO2,D的结构式为O=C=O;正确答案:CuCO3或Cu2(OH)2CO3;![]() ;O=C=O。
;O=C=O。
(2)将22.4L(标准状况)CO2气体通入1L 1mol/L NaOH溶液中,完全吸收后恰好完全反应生成溶液为NaHCO3溶液,溶液除了Na+外,还大量存在的离子是HCO3-;正确答案是:HCO3-。
((3)已知M为铜,与稀硝酸反应,溶液变成蓝色,生成硝酸铜,并放出无色气体一氧化氮;反应的离子方程式为3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O ;正确答案:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O 。
(4)检验亚铁离子,可向待测溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变红,说明有![]() 存在;正确答案:向待测溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变红,说明有Fe2+存在。
存在;正确答案:向待测溶液中先加入KSCN溶液,无明显现象,再加入氯水,溶液变红,说明有Fe2+存在。
(5)![]() →L为氯气和氯化亚铁反应生成氯化铁的反应,离子方程式为2Fe2++Cl2==2Fe3++2Cl-;正确答案:2Fe2++Cl2===2Fe3++2Cl-。
→L为氯气和氯化亚铁反应生成氯化铁的反应,离子方程式为2Fe2++Cl2==2Fe3++2Cl-;正确答案:2Fe2++Cl2===2Fe3++2Cl-。

 阅读快车系列答案
阅读快车系列答案【题目】根据下列实验现象,所得结论错误的是( )
实验 | 实验现象 | 结论 |
A |
| 活动性:Al>Fe>Cu |
B |
| 铜与浓硝酸的反应产物是NO |
C |
| 增大反应物浓度,平衡向正反应方向移动 |
D |
| 装置气密性良好 |
A.A
B.B
C.C
D.D