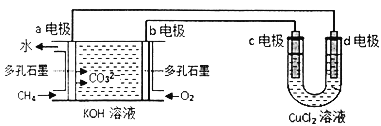
��Ŀ����
����Ŀ��X��Y��Z��U��W��ԭ���������������ǰ������Ԫ�ء�����Y��ԭ�Ӻ�����7���˶�״̬��ͬ�ĵ��ӣ�X��Z��δ�ɶԵ�������Ϊ2��U�ǵ�������Ԫ���γɵļ������а뾶��С��Ԫ�أ�W���ڲ����ȫ�����������ֻ��1�����ӡ���ش��������⣺
��1��X��Y��Z�ĵ�һ�����ܴӴ�С��˳����_____________ (��Ԫ�ط��ű�ʾ����ͬ)��
��2��д��W�ļ۵����Ų�ʽ__________________________��Wͬ���ڵ�Ԫ���У���Wԭ��������������ȵ�Ԫ�ػ���_____________��
��3��X��Y��Z�ļ��⻯��ļ��ǴӴ�С��˳����__________________________(�û�ѧʽ��ʾ)��ԭ����__________________________��
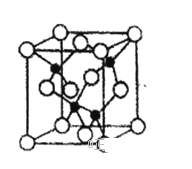
��4����Ԫ��Y��UԪ����ɵĻ�����A�������ṹ��ͼ��ʾ�������ʾYԭ�ӣ������ʾUԭ�ӣ�����д��������A�Ļ�ѧʽ_____________��������Ӳ�ȴ��Ʋ������Ϊ_____________���塣����YԪ�ص��ӻ���ʽ��_____________��
���𰸡� N>O>C 3d104s1 K��Cr CH4>NH3>H2O 3���⻯�������ԭ�Ӽ۲���Ӷ�����Ϊ4����Ϊ��������ṹ��������ԭ�ӵŵ��Ӷ����������ӣ����¼��DZ�С AlN ԭ�� sp3
��������X��Y��Z��U��W��ԭ���������������ǰ������Ԫ�ء�����Y��ԭ�Ӻ�����7���˶�״̬��ͬ�ĵ��ӣ���YΪNԪ�أ��ڶ���ӵ�ԭ���У��κ�һ�����ӵ��˶�״̬�����������Ӳ�ͬ����X��Z��δ�ɶԵ�������Ϊ2����X��Z�ֱ�ΪCԪ�غ�OԪ����U�ǵ�������Ԫ���γɵļ������а뾶��С��Ԫ�أ���UΪAlԪ����W���ڲ����ȫ�����������ֻ��1�����ӣ���WΪCuԪ����
��1��X��Y��Z�ĵ�һ�����ܴӴ�С��˳����N>O>C��
��2��Cu�ļ۵����Ų�ʽΪ3d104s1��Wͬ���ڵ�Ԫ���У���Wԭ��������������ȵ�Ԫ�ػ���K��Cr ��
��3��X��Y��Z�ļ��⻯��ļ��ǴӴ�С��˳����CH4>NH3>H2O��ԭ����3���⻯�������ԭ�Ӽ۲���Ӷ�����Ϊ4����۲���ӶԻ���ģ�Ͷ�����������ṹ��������ԭ�ӵŵ��Ӷ����������ӣ����¼��DZ�С��
��4����Ԫ��N��AlԪ����ɵĻ�����AlN�ľ����ṹʾ��ͼ��֪���þ�����Nԭ�Ӻ�Alԭ�Ӷ���4�������Ի�����A�Ļ�ѧʽΪAlN��������Ӳ�ȴ��Ʋ������Ϊԭ�Ӿ��塣��Ϊÿ��Nԭ���γ�4�����������ݼ۲���ӶԻ������ۿ����жϳ�Nԭ�ӵ��ӻ���ʽ��sp3�ӻ���