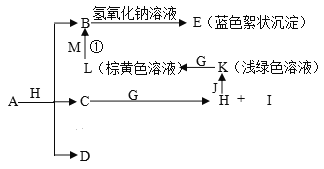
题目内容
【题目】取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00molL﹣1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100molL﹣1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00mlL﹣1盐酸恰好完全中和.计算:
(1)混合物中Na2SO4的质量;
(2)混合物中Na2CO3的物质的量.
【答案】
(1)解:加入氢氧化钡溶液后生成的沉淀为硫酸钡,根据硫酸根离子守恒可知:混合物中Na2SO4的质量= ![]() ×142g/mol=1.42g,
×142g/mol=1.42g,
答:混合物中含有硫酸钠的质量为1.42g;
(2)解:设混合物中NaCO3和NaHCO3的物质的量分别为x和y,反应中放出的CO2物质的量= ![]() =0.090mol,
=0.090mol,
根据碳原子守恒可知:①x+y=0.09mol,
与Na2CO3、NaHCO3反应的盐酸的物质的量为:1.0mol/L×0.25L+1mol/L×0.01L﹣0.1mol/L×0.5L×2=0.16mol,
则:②2x+y=0.16mol,
根据①②解得:x=0.07mol、y=0.02mol,
即:混合物中含有碳酸钠的物质的量为0.07mol,
答:混合物中含有0.07mol碳酸钠.
【解析】(1)生成的2.33g沉淀为硫酸钡,根据硫酸根离子守恒可计算出原混合物中硫酸钠的物质的量、质量;(2)根据消耗的盐酸、氢氧化钡的物质的量计算出碳酸钠、碳酸氢钠消耗的氯化氢的物质的量,然后根据生成的二氧化碳、消耗的氯化氢的量分别列式计算出碳酸钠的物质的量.

【题目】羰基硫(O=C=S)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。羰基硫的氢解反应和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=+7kJ/mol
H2S(g)+CO(g) △H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2
H2S(g)+CO2(g) △H2
已知反应中相关的化学键键能数据如下:
化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
E/kJ·mol-1 | 803 | 742 | 577 | 339 | 465 |
回答下列问题:
(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为____kJ。
(2)已知热化学方程式CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
(3)某温度下,在某密闭容器中进行COS的氢解反应
①当反应达到限度后,增大容器的体积,则正反应速率_____(填“增大”“减小”或“不变”);
②当容器体积不变时,若起始时充入COS和H2的体积比为1:2,下列情形能表明反应达到平衡状态的是______。
a.气体密度不变 b.COS与H2浓度比不变
c.混合气体的平均相对分子质量不变 d.COS体积分数不变
③当容器体积不变时,若COS和H2的起始物质的量比为1:a,平衡后COS和H2的物质的量比为1:10a,则此温度下H2平衡转化率为______(用含a的式子表示)。
(4)羰基硫的氢解或水解反应能否设计成原电池_____(能或否),理由是________。
(5)用金属储氢材料(MH)、铂(Pt)、硫酸溶液组成的原电池可以使羰基硫脱硫处理。
①原电池的负极材料是____(填化学式)。
②写出原电池的正极反应式_________,正极周围溶液pH______(填“增大”“减小”或“不变”)。
③原电池工作时,硫酸溶液的作用是___________。