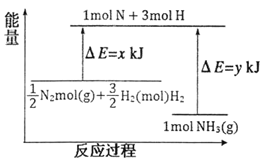
��Ŀ����
����Ŀ����֪����Ԫ�ص�ԭ��������С˳��ΪC>A>B>D>E��A��Cͬ���ڣ�B��Cͬ���塣A��B�γɵ����ӻ�����A2B���������ӵĵ�������ͬ�����������Ϊ30��D��E���γ�4��10�����ӵķ��ӡ��Իش��������⣺
��1��д������Ԫ�ص����ƣ�A________B_______C__________D_________
��2���õ���ʽ��ʾ������A2B���γɹ��̣�______________________��
��3��д��DԪ���γɵĵ��ʵĽṹʽ��__________________________��
��4��A��B����Ԫ����ɵĻ�����A2B2���ڵĻ�ѧ����________________��
��5��д���������ʵĵ���ʽ��E��B�γɵĻ�����__________________��A��B��E�γɵĻ�����_____________��
���𰸡� �� �� �� �� ![]() N��N ���Ӽ����ۼ�
N��N ���Ӽ����ۼ� ![]() ��
��![]()
![]()
��������A��B�γ����ӻ�����A2B���������ӵĵ�������ͬ���ҵ�������Ϊ30������ÿ�����Ӷ���10�����ӣ��ɻ�ѧʽ�Ľṹ��֪��B��2����λ����ɣ�A��1����λ����ɣ�����A��NaԪ�أ�B��OԪ�أ���ΪA��Cͬ���ڣ�B��Cͬ���壬����CΪSԪ�أ�D��E���γ�4��10���ӵķ��ӣ�ԭ������B��D��E����֪�÷�����NH3������D��NԪ�أ�E��HԪ�أ���
��1���������Ϸ�����֪AΪ�ƣ�BΪ����CΪ��DΪ������2��A2B��Na2S������Ϊ���ӻ�����õ���ʽ��ʾNa2S���γɹ���Ϊ![]() ����3�������ĽṹʽΪN��N����4��A��B����Ԫ����ɵĻ�����A2B2�ǹ������ƣ����ڵĻ�ѧ�������Ӽ����ۼ�����5��E��B�γɵĻ�������ˮ��˫��ˮ������ʽΪ
����3�������ĽṹʽΪN��N����4��A��B����Ԫ����ɵĻ�����A2B2�ǹ������ƣ����ڵĻ�ѧ�������Ӽ����ۼ�����5��E��B�γɵĻ�������ˮ��˫��ˮ������ʽΪ![]() ��
��![]() ��A��B��E�γɵĻ�����Ϊ�������ƣ�NaOH�к��������������������ӹ��ɵ����Ӽ���O��H�γɹ��ۼ�������ʽΪ
��A��B��E�γɵĻ�����Ϊ�������ƣ�NaOH�к��������������������ӹ��ɵ����Ӽ���O��H�γɹ��ۼ�������ʽΪ![]() ��
��

 ̽���빮�̺��Ͽ�ѧ����������ϵ�д�
̽���빮�̺��Ͽ�ѧ����������ϵ�д�