题目内容
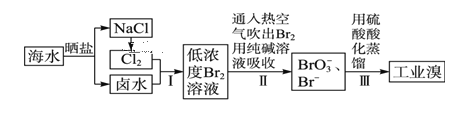
【题目】对于锌、铜和稀硫酸组成的原电池(如下图),下列说法错误的是
A. 负极电极反应式为Zn-2e- =Zn2+
B. 溶液中SO42-离子向负极移动
C. 电子由Zn片通过稀硫酸流向Cu片
D. 铜片上有气泡产生
【答案】C
【解析】
该原电池中,锌易失电子作负极,电极反应式为Zn-2e-═Zn2+,铜作正极,电极反应为2H++2e-═H2↑,电子从负极沿导线流向正极。
A.该装置中,锌失电子发生氧化反应而作负极,电极反应式为Zn-2e-═Zn2+,选项A正确;
B.原电池溶液中阴离子SO42-离子向负极移动,选项B正确;
C.电子从负极锌沿导线流向正极Cu,电子不进入电解质溶液,选项C错误;
D.铜作正极,正极是上氢离子放电,电极反应为2H++2e-═H2↑,故铜片上产生气泡,选项D正确;
答案选C。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是)
选项 | 已知 | 类推 |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+=== Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=== Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-=== CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=== CaSO3↓+2HClO |
C | 惰性电极电解氯化钠溶液:2Cl-+2H2O | 惰性电极电解MgBr2溶液:2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O | 稀硝酸与Ba(OH)2溶液反应至中性:H++OH-===H2O |
A. A B. B C. C D. D
【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D