题目内容
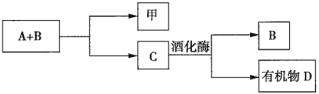
【题目】现有单质A、B、C及化合物D、E、F、G、H,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
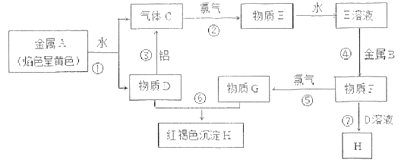
请根据以上信息回答下列问题:
(1)反应③是D物质的水溶液与金属铝反应,金属铝被氧化___(写化学式);
(2)步骤⑦中刚生成的白色沉淀颜色会迅速发生变化,最终生成红褐色沉淀H,请写出由白色沉淀变成H的化学方程式:___;
(3)检验G中所含的金属离子时,在G溶液中加入硫氰化钾溶液,离子方程式为:___;
(4)工业上将氯气通入D溶液中制取消毒液,反应的化学方程式为___,1mol氯气发生反应,转移电子___mol;消毒液中的有效成分是___(填名称);
(5)将0.1molA的碳酸盐溶液和0.15molE溶液混合,有如下两种方式:
A.将含A的碳酸盐溶液逐滴加入到E溶液中;
B.将E溶液逐滴加入到含A的碳酸盐溶液中;
理论上产生气体比较多的是___(填序号),多___mol。
【答案】![]()
![]()
![]()
![]() 1 次氯酸钠 A
1 次氯酸钠 A ![]()
【解析】
金属A焰色反应为黄色,故A为Na,由反应![]() 水
水![]() 气体
气体![]() ,故C为
,故C为![]() 、D为NaOH,则E为HCl,HCl溶于水形成盐酸。金属B能与盐酸反应生成F,F与氯气反应生成G,而G能与NaOH反应生成红褐色沉淀H,故B为Fe、F为
、D为NaOH,则E为HCl,HCl溶于水形成盐酸。金属B能与盐酸反应生成F,F与氯气反应生成G,而G能与NaOH反应生成红褐色沉淀H,故B为Fe、F为![]() 、H为
、H为![]() ,据此解答。
,据此解答。
![]() 反应
反应![]() 是NaOH水溶液与金属铝反应,本质是Al与水反应生成氢氧化铝与氢气,氢氧化铝再与NaOH反应生成偏铝酸钠与水,金属铝被
是NaOH水溶液与金属铝反应,本质是Al与水反应生成氢氧化铝与氢气,氢氧化铝再与NaOH反应生成偏铝酸钠与水,金属铝被![]() 氧化,故答案为:
氧化,故答案为:![]() ;
;![]() 步骤
步骤![]() 中刚生成的白色沉淀氢氧化亚铁易被氧化,颜色会迅速发生变化,最终生成红褐色沉淀氢氧化铁,化学方程式为:
中刚生成的白色沉淀氢氧化亚铁易被氧化,颜色会迅速发生变化,最终生成红褐色沉淀氢氧化铁,化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 检验
检验![]() 中所含的金属离子时,在
中所含的金属离子时,在![]() 溶液中加入硫氰化钾溶液,溶液变红,离子方程式为:
溶液中加入硫氰化钾溶液,溶液变红,离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() 工业上将氯气通入NaOH溶液中制取消毒液NaClO,反应的化学方程式为:
工业上将氯气通入NaOH溶液中制取消毒液NaClO,反应的化学方程式为:![]() ,根据氧化还原反应化合价规律可知,氯气中的Cl有一半化合价升高,一半化合价降低,即反应中氯气既是氧化剂又是还原剂,各占一半,1mol氯气发生反应转移1mol电子,消毒液中的有效成分是次氯酸钠,故答案为:
,根据氧化还原反应化合价规律可知,氯气中的Cl有一半化合价升高,一半化合价降低,即反应中氯气既是氧化剂又是还原剂,各占一半,1mol氯气发生反应转移1mol电子,消毒液中的有效成分是次氯酸钠,故答案为:![]() ;1;次氯酸钠;
;1;次氯酸钠;
![]() .将碳酸钠溶液逐滴加入到盐酸中,发生反应:
.将碳酸钠溶液逐滴加入到盐酸中,发生反应:![]() ,生成
,生成![]() 为
为![]() ;
;
B.将盐酸逐滴加入到含碳酸钠溶液中,先发生反应:![]() ,剩余
,剩余![]() 、生成
、生成![]() ,而后发生反应:
,而后发生反应:![]() ,生成
,生成![]() ;故理论上产生气体比较多的是A,多产生
;故理论上产生气体比较多的是A,多产生![]() 为
为![]() 。
。
故答案为:A;![]() 。
。