题目内容
某探究小组在某温度下测定溶液的pH时发现:0.01 mol/L的NaOH的溶液中,由水电离出的C(OH-).C(H+) = 10-22 (mol/L)2,则该小组在该温度下测得0.1 mol/L NaOH溶液的pH应为 ( )
| A.13 | B.12 | C.11 | D.10 |
B
0.01 mol/L的NaOH的溶液中,因NaOH是强碱,完全电离,则CNaOH(OH-)=10-2 mol/L;
由水电离出的C(OH-).C(H+) = 10-22 (mol/L)2,得: C水(H+)= C水(OH-)=10-11,
所以:在该温度下,Kw= C水(H+)×CNaOH(OH-)=10-13 (mol/L)2;
则0.1 mol/L NaOH溶液中:C水(H+)=" Kw" / CNaOH(OH-)=10-13/10-1=10-12 mol/L,PH=12
由水电离出的C(OH-).C(H+) = 10-22 (mol/L)2,得: C水(H+)= C水(OH-)=10-11,
所以:在该温度下,Kw= C水(H+)×CNaOH(OH-)=10-13 (mol/L)2;
则0.1 mol/L NaOH溶液中:C水(H+)=" Kw" / CNaOH(OH-)=10-13/10-1=10-12 mol/L,PH=12

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 大小顺序是③>②>①
大小顺序是③>②>①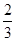 c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3)
c(Na+)= c(HCO3—)+ c(CO32—)+ c(H2CO3)