题目内容
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目增加,导电性增强 |
| B.醋酸的电离程度增大,[H+]减小 |
| C.再加入10mL pH="11" NaOH溶液,混合液pH=7 |
| D.溶液中由水电离出的[H+]=1×10-11 mol/L |
B
试题分析:A.溶液中导电粒子的数目增加,但由于离子的浓度减小,所以溶液的导电性减弱。错误。B.醋酸溶液稀释,电离平衡正向移动,使醋酸的电离程度增大,由于稀释作用大于平衡移动使离子浓度增大的趋势,所以总的来说离子的浓度减小。所以正确。C.若加入等体积等离子浓度的NaOH溶液,电离的部分恰好中和,由于醋酸是弱电解质,n(CH3COOH)>n(NaOH),未电离的部分会继续电离,最终使溶液显酸性。错误。D,加水稀释前C(H+)=10-3mol/L,因为C(H+)?C(OH-)=Kw=10-14.所以C(OH-) ="Kw" ÷C(H+) = 10-14÷10-3 =10-11.加水,使溶液的氢离子的浓度减小,溶液中氢氧根离子的浓度增大,及由水电离产生的氢离子浓度增大。要大于1×10-11 mol/L。错误。

练习册系列答案
相关题目
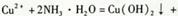
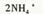
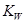 表示水的离子积,a表示水的电离度,能使
表示水的离子积,a表示水的电离度,能使 的值增大的是
的值增大的是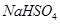

 H++OH-,在不同温度下其平衡常数为Kw(25 ℃)=1.0×10-14,Kw(35 ℃)=2.1×10-14。则下列叙述正确的是
H++OH-,在不同温度下其平衡常数为Kw(25 ℃)=1.0×10-14,Kw(35 ℃)=2.1×10-14。则下列叙述正确的是