题目内容
Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 回答下列问题。
CH3OH(g)+H2O(g) ΔH1 回答下列问题。
(1)已知:2H2(g)+O2(g)=2H2O(g) ΔH2
则反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH= (用含ΔH1、ΔH2表示)
(2)若反应温度升高,CO2的转化率 (填“增大”“减小”或“不变”)。
(3)写出在酸性环境中,甲醇燃料电池中的正极反应方程式
Ⅱ:生产甲醇的原料H2可用如下方法制得:CH4(g) + H2O(g) CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:

(4)反应进行到4分钟到达平衡。请计算从反应开始到刚刚平衡,平均反应速率v(H2)为 ;并求此反应在此温度下的平衡常数(在答题卡对应的方框内写出计算过程)。
(5)在第5分钟时将容器的体积瞬间缩小一半后,若在第8分钟时达到新的平衡(此时CO的浓度约为0.25 mol·L—1 ),请在图中画出第5分钟后H2浓度的变化曲线。
 CH3OH(g)+H2O(g) ΔH1 回答下列问题。
CH3OH(g)+H2O(g) ΔH1 回答下列问题。(1)已知:2H2(g)+O2(g)=2H2O(g) ΔH2
则反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH= (用含ΔH1、ΔH2表示)
(2)若反应温度升高,CO2的转化率 (填“增大”“减小”或“不变”)。
(3)写出在酸性环境中,甲醇燃料电池中的正极反应方程式
Ⅱ:生产甲醇的原料H2可用如下方法制得:CH4(g) + H2O(g)
 CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
(4)反应进行到4分钟到达平衡。请计算从反应开始到刚刚平衡,平均反应速率v(H2)为 ;并求此反应在此温度下的平衡常数(在答题卡对应的方框内写出计算过程)。
(5)在第5分钟时将容器的体积瞬间缩小一半后,若在第8分钟时达到新的平衡(此时CO的浓度约为0.25 mol·L—1 ),请在图中画出第5分钟后H2浓度的变化曲线。
19(除指定外,其余每空2分,共15分)
Ⅰ(1) 3ΔH2-2ΔH1 (2)减小 (3)O2 + 4e- + 4H+ = 2H2O
Ⅱ(4)0.075 mol·L-1·min-1
(此空4分) CH4(g) + H2O(g) CO(g) + 3H2(g)
CO(g) + 3H2(g)
起始(mol·L-1) 0.2 0.4
变化(mol·L-1) 0.1 0.1 0.1 0.3
平衡(mol·L-1) 0.1 0.3 0.1 0.3
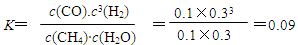
(5)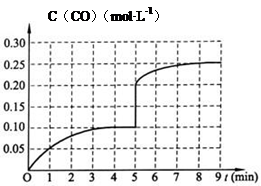 (3分,起点标对得1分,拐点、平台标对得1分、走势对得1分。5分钟时不画垂直连接线不扣分)
(3分,起点标对得1分,拐点、平台标对得1分、走势对得1分。5分钟时不画垂直连接线不扣分)
Ⅰ(1) 3ΔH2-2ΔH1 (2)减小 (3)O2 + 4e- + 4H+ = 2H2O
Ⅱ(4)0.075 mol·L-1·min-1
(此空4分) CH4(g) + H2O(g)
 CO(g) + 3H2(g)
CO(g) + 3H2(g)起始(mol·L-1) 0.2 0.4
变化(mol·L-1) 0.1 0.1 0.1 0.3
平衡(mol·L-1) 0.1 0.3 0.1 0.3
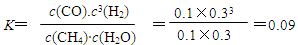
|
 (3分,起点标对得1分,拐点、平台标对得1分、走势对得1分。5分钟时不画垂直连接线不扣分)
(3分,起点标对得1分,拐点、平台标对得1分、走势对得1分。5分钟时不画垂直连接线不扣分)试题分析:(1)根据已知的两个方程式和所求方程式可知,所求方程式可由3×②-2×①所得,所以ΔH=3ΔH2-2ΔH1
(2)因为反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)是一个放热反应,所以根据平衡移动原理,温度升高,平衡左移,所以CO2 的转化率减小。
CH3OH(g)+H2O(g)是一个放热反应,所以根据平衡移动原理,温度升高,平衡左移,所以CO2 的转化率减小。(3)电池的总反应方程式已经给出,根据总反应式2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g),O2 做氧化剂化合价降低,所以正极发生的是3个O2 得12个e-。由于是酸性介质,所以不能有OH- 参与反应,所以参与的是H+ ,同时生成水,所以反应式为3O2 + 12e- + 12H+ = 6H2O,化简后为O2 + 4e- + 4H+ = 2H2O。
(4)图像中的纵坐标是CO的浓度,所以要求氢气的平均反应速率需要根据方程式进行变形,所以v(H2)=" 3v(CO)=3ΔC/Δt=0.3" mol·L-1/4 min ="0.075" mol·L-1·min-1 。
平衡常数的计算过程为:
CH4(g) + H2O(g)
 CO(g) + 3H2(g)
CO(g) + 3H2(g)起始(mol·L-1) 0.2 0.4
变化(mol·L-1) 0.1 0.1 0.1 0.3
平衡(mol·L-1) 0.1 0.3 0.1 0.3
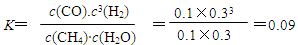
(5)体积缩小一半后,压强增大且各组分的浓度瞬间增大1倍,所以图像的起点由0.1 mol·L—1瞬间增大到0.2 mol·L—1;又压强增大平衡往系数减小的一边移动,所以CO的浓度增大到约为0.25 mol·L—1 为终点。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
 和
和 。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。
。实验测得N-N键键能为167kJ·mol-1, NO2中氮氧键的平均键能为466 kJ·mol-1,N2O4中氮氧键的平均键能为438.5 kJ·mol-1。 2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 
 N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。
N2O4的平衡常数K将 (填“增大”、“减小”或“不变”)。 O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1
O2(g)=ZnO(s) ΔH1=-351.1 kJ·mol-1 3N2+2X+4H2O
3N2+2X+4H2O  4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应
4NO(g)+6H2O(g) △H =" —905" kJ/mol ①主反应