题目内容
【题目】若将 SO2 通入硝酸钡溶液中,有白色沉淀产生,其化学反应方程式如下(未配平): SO2+ Ba(NO3)2+ H2O —— BaSO4↓+ HNO3+ NO↑
(1)配平上述化学反应方程式并用双线桥表示电子转移的方向和数目________。
(2)该反应中,_______发生氧化反应,氧化剂是_______。氧化产物与还原产物的物质的量之比为 _______。
(3)当反应消耗二氧化硫 19.2 g 时,反应中转移电子数目为_______ ,生成 NO 的体积为 _______(标准状况)。
【答案】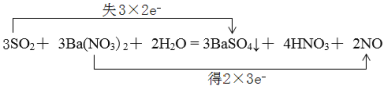 ; SO2 Ba(NO3)2 3:2 0.6NA 4.48L
; SO2 Ba(NO3)2 3:2 0.6NA 4.48L
【解析】
根据电子得失守恒、质量守恒可配平化学方程式;氧化还原反应中,氧化剂得电子,被还原为还原产物,还原剂失电子,被氧化为氧化产物;氧化还原反应中转移的电子数等于失电子总数。
(1)反应中化合价变化为:S:+4→+6,1molSO2失2mol电子;N:+5→+2,生成1mol NO得3mol电子;根据电子得失守恒,反应中SO2和NO的物质的量之比为:3:2,根据质量守恒可进一步配平上述化学反应方程式为:3SO2+ 3Ba(NO3)2+ 2H2O = 3BaSO4↓+ 4HNO3+ 2NO,电子转移的方向和数目用双线桥表示为: 。
。
答案为: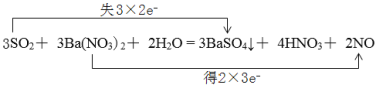 ;
;
(2)该反应中,S元素化合价升高,N化合价降低,所以,SO2发生氧化反应,是还原剂,得到氧化产物BaSO4;Ba(NO3)2是氧化剂,发生还原反应,得到还原产物NO。根据配平的化学方程式可知,氧化产物BaSO4和还原产物NO的物质的量之比为3:2。
答案为:SO2;Ba(NO3)2;3:2;
(3)反应中n(SO2) =![]() ,转移的电子数等于失电子总数,所以,反应中转移电子数目为:0.3mol×2×NAmol-1=0.6NA;生成标准状况下NO 的体积为:0.3mol×
,转移的电子数等于失电子总数,所以,反应中转移电子数目为:0.3mol×2×NAmol-1=0.6NA;生成标准状况下NO 的体积为:0.3mol×![]() ×22.4Lmol-1=4.48L。
×22.4Lmol-1=4.48L。
答案为:0.6NA;4.48L。