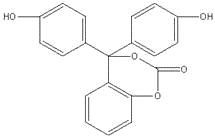
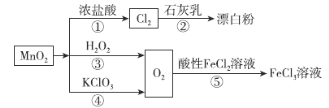
题目内容
【题目】一种新型的合成氨的方法如图所示,下列说法错误的是

A.反应①属于“氮的固定”
B.反应②属于非氧化还原反应
C.反应③可通过电解LiOH水溶液实现
D.上述三步循环的总反应方程式为2N2+6H2O=4NH3+3O2
【答案】C
【解析】
A.反应①是Li和氮气反应生成Li3N的过程中是游离态氮元素转化为化合态,为氮的固定,故A正确;
B.反应②是Li3N和水反应生成LiOH和NH3,反应过程中无元素化合价变化,为非氧化还原反应,故B正确;
C.电极LiOH溶液阳极氢氧根离子失电子生成氧气,阴极是氢离子得到电子生成氢气,不能得到金属Li,故C错误;
D.三步反应6Li+N2=2Li3N、Li3N+3H2O=3LiOH+NH3、4LiOH ![]() 4Li+O2↑+2H2O,上述三步循环的总结果为2N2+6H2O═4NH3+3O2,故D正确;
4Li+O2↑+2H2O,上述三步循环的总结果为2N2+6H2O═4NH3+3O2,故D正确;
故答案为C。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:为制备纯净干燥的气体,下表中缺少的药品是:
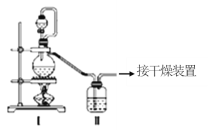
制备原料 | 装置Ⅰ | 装置Ⅱ | |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__ | 饱和食盐水 |
制备纯净NO | Cu | 稀硝酸 | ②__ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
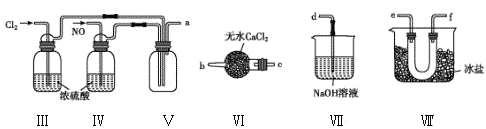
①装置连接顺序为a→____(按气流自左向右方向,用小写字母表示)。
②为了使气体充分反应,实验中先通入Cl2,待装置Ⅴ中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是______(回答一条即可)。
③装置Ⅴ生成NOCl的化学方程式是________。
④装置Ⅵ的作用为___,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为__。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:
取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为bmL。亚硝酰氯(NOCl)的质量分数为______(用代数式表示即可)。