题目内容
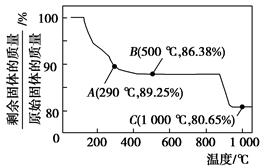
Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。
钴的有关性质如下:Co(OH)2具有两性。钴的主要物理、化学参数与铁、镍接近,属铁族元素。
结合以上信息试回答下列问题:
(1)Co(OH)2的制备是在CoCl2溶液中加稍过量的氨水,不用NaOH溶液的原因是________________________________(用化学方程式表示)。制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化,化学方程式为_____________________________________________________。
(2)如图,已知钴的氢氧化物加热至290 ℃时已完全脱水,则1000 ℃时,剩余固体的成分为________________________(填化学式);在290~500 ℃范围内,发生的反应的化学方程式为__________________________________________。
(3)已知常温下,在0.10 mol·L-1 CoCl2溶液中加入氨水充分搅拌,有Co(OH)2沉淀生成,当溶液的pH=8时,c(Co2+)=________mol·L-1(Ksp[Co(OH)2]=1.6×10-15)。常温下反应Co2++2H2O??Co(OH)2+2H+的平衡常数为
_______________________________。

钴的有关性质如下:Co(OH)2具有两性。钴的主要物理、化学参数与铁、镍接近,属铁族元素。
结合以上信息试回答下列问题:
(1)Co(OH)2的制备是在CoCl2溶液中加稍过量的氨水,不用NaOH溶液的原因是________________________________(用化学方程式表示)。制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化,化学方程式为_____________________________________________________。
(2)如图,已知钴的氢氧化物加热至290 ℃时已完全脱水,则1000 ℃时,剩余固体的成分为________________________(填化学式);在290~500 ℃范围内,发生的反应的化学方程式为__________________________________________。
(3)已知常温下,在0.10 mol·L-1 CoCl2溶液中加入氨水充分搅拌,有Co(OH)2沉淀生成,当溶液的pH=8时,c(Co2+)=________mol·L-1(Ksp[Co(OH)2]=1.6×10-15)。常温下反应Co2++2H2O??Co(OH)2+2H+的平衡常数为
_______________________________。
(1)Co(OH)2+2NaOH=Na2CoO2+2H2O
4Co(OH)2+O2+2H2O=4Co(OH)3
(2)CoO 6Co2O3 4Co3O4+O2↑
4Co3O4+O2↑
(3)1.6×10-3 6.25×10-14
4Co(OH)2+O2+2H2O=4Co(OH)3
(2)CoO 6Co2O3
 4Co3O4+O2↑
4Co3O4+O2↑(3)1.6×10-3 6.25×10-14
(1)类似于Al(OH)3溶于NaOH,注意Co显+2价;钴类似于铁,可知Co(OH)2在空气中被氧化,类似于Fe(OH)2被氧化。(2)由于Co有+2、+3价,原始为Co(OH)2,相对分子质量为93;剩余固体若为CoO,则固体残留率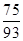 ×100% = 80.65%(C点);剩余固体若为Co2O3,则固体残留率为
×100% = 80.65%(C点);剩余固体若为Co2O3,则固体残留率为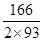 ×100%=89.25%(A点),B点介于两者之间,+2价与+3价均有,联想Fe的氧化物,可能为Co3O4,此时固体残留率为
×100%=89.25%(A点),B点介于两者之间,+2价与+3价均有,联想Fe的氧化物,可能为Co3O4,此时固体残留率为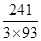 ×100%=86.38%(B点)。AB段发生反应是Co2O3生成Co3O4。(3) 由Ksp[Co(OH)2]=1.6×10-15=
×100%=86.38%(B点)。AB段发生反应是Co2O3生成Co3O4。(3) 由Ksp[Co(OH)2]=1.6×10-15=
c(Co2+)·c2(OH-)=c(Co2+)×(10-6)2。得c(Co2+)=1.6×10-3 mol·L-1。反应
Co2++2H2O??Co(OH)2+2H+的平衡常数K=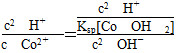
=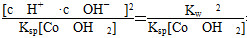 =6.25×10-14。
=6.25×10-14。
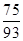 ×100% = 80.65%(C点);剩余固体若为Co2O3,则固体残留率为
×100% = 80.65%(C点);剩余固体若为Co2O3,则固体残留率为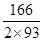 ×100%=89.25%(A点),B点介于两者之间,+2价与+3价均有,联想Fe的氧化物,可能为Co3O4,此时固体残留率为
×100%=89.25%(A点),B点介于两者之间,+2价与+3价均有,联想Fe的氧化物,可能为Co3O4,此时固体残留率为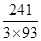 ×100%=86.38%(B点)。AB段发生反应是Co2O3生成Co3O4。(3) 由Ksp[Co(OH)2]=1.6×10-15=
×100%=86.38%(B点)。AB段发生反应是Co2O3生成Co3O4。(3) 由Ksp[Co(OH)2]=1.6×10-15=c(Co2+)·c2(OH-)=c(Co2+)×(10-6)2。得c(Co2+)=1.6×10-3 mol·L-1。反应
Co2++2H2O??Co(OH)2+2H+的平衡常数K=
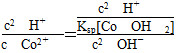
=
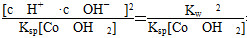 =6.25×10-14。
=6.25×10-14。
练习册系列答案
相关题目