题目内容
下列关于碱金属及其化合物的叙述错误的是( )
| A.金属钠投入Ca(HCO3)2溶液,反应后有白色沉淀析出 |
| B.干粉灭火器能用于扑灭金属钠、钾的着火 |
| C.生理盐水的质量分数为0.9%,与人体的血液中含量相同,它的溶质是NaCl |
| D.取用金属钠、钾时,所需实验用品有小刀、镊子、滤纸、玻璃片 |
B
试题分析:钠是活泼的金属,极易和水反应生成氢气和氢氧化钠。生成的氢氧化钠和碳酸氢钙反应生成白色沉淀碳酸钙,A正确;钠着火生成过氧化钠,过氧化钠和CO2反应生成氧气,B不正确;同样分析可知,选项CD是正确的,答案选B。
点评:该题是基础性试题的考查,也是高考中的常见考点,难度不大。该题的关键是记住钠及其化合物的性质、用途,然后灵活运用即可。

练习册系列答案
 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
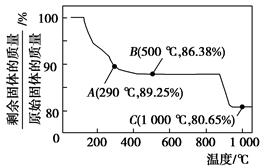
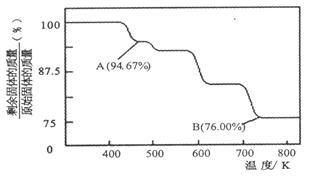
 Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是 。
Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是 。