题目内容
【题目】元素原子的核外电子排布决定了元素在元素周期表中的位置,已知某元素原子的核外电子排布式为1s22s22p63s23p63d34s2。该元素位于元素周期表
A. 第4周期第ⅤB族 B. 第4周期第ⅡA族
C. 第2周期第ⅡB族 D. 第5周期第ⅡB族
【答案】A
【解析】
原子结构决定元素的位置,主族元素的最外层电子数等于族序数,副族元素的价电子数决定族序数,电子层数等于周期数,以此来解答。
由元素原子的核外电子排布式为1s22s22p63s23p63d34s2,可知电子层数为4,位于第四周期,且价电子排布为3d34s2,为第VB族元素,故选:A。

练习册系列答案
相关题目
【题目】用下图装置进行①中实验,对应②中现象正确,且能达成相应实验目的的是( )
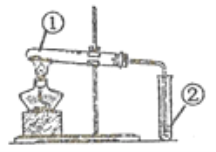
选项 | ①中实验 | ②中现象 | 实验目的 |
A | 将浸透石蜡油的石棉加热 | Br2的CCl4溶液褪色 | 石蜡裂解产物中含有烯烃 |
B | 加热NH4Cl固体 | 酚酞溶液变红 | 制备氨气并检验氨气性质 |
C | 加热NaHCO3与Na2CO3混合粉末 | 澄清石灰水变浑浊 | 验证NaHCO3具有热不稳定性 |
D | 加热铁粉及湿棉花 | 肥皂水中有气泡冒出 | Fe与H2O发生了置换反应 |
A. A B. B C. C D. D