题目内容
11.1-18号元素中某核素A的阳离子An+核外共有X个 电子,则核素A的最外层电子数为( )| A. | x+n | B. | x-n | C. | n | D. | n+2 |
分析 1-18号元素金属元素失去电子为阳离子,阳离子An+核外共有X个电子,可知A易失去n个电子,以此来解答.
解答 解:1-18号元素金属元素失去电子为阳离子,阳离子An+核外共有X个电子,可知A易失去n个电子,则核素A的最外层电子数为n,故选C.
点评 本题考查原子核外电子排布,为高频考点,把握主族元素中最外层电子数与失去电子数相等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
2.甲醇是重要的化学工业基础原料和液体燃料,工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
(1)反应②是吸热(填“吸热”或“放热”)反应.
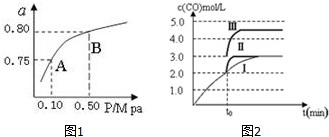
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)= K(B)(填“>”、“<”或“=”).
(3)判断反应③△H<0;△S<0(填“>”、“<”或“=”)
(4)在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)> v(逆) (填“>”、“<”或“=”)
(5)一定温度下,在3L容积可变的密闭容器中发生反应②,已知 c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
(6)用于汽车净化的一个反应2NO(g)+2CO(g)═N2(g)+2CO2(g)在298K、100kPa下能(填“能”或“不能”) 自发进行,原因是△G=△H-T△S=-113.0 kJ•mol-1-298 K×(-145.3 J•mol-1•K-1)×10-3≈-69.7 kJ•mol-1<0,可以自发进行.已知:在298K、100kPa下该反应的△H=-113.0kJ•mol-1,△S=-145.3J•mol-1•K-1.
| 化学反应 | 平衡常数 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图1所示.则平衡状态由A变到B时,平衡常数K(A)= K(B)(填“>”、“<”或“=”).
(3)判断反应③△H<0;△S<0(填“>”、“<”或“=”)
(4)在500℃、2L的密闭容器中,进行反应③,测得某时刻H2、CO2、CH3OH、H2O的物质的量分别为6mol、2mol、10mol、10mol,此时v(正)> v(逆) (填“>”、“<”或“=”)
(5)一定温度下,在3L容积可变的密闭容器中发生反应②,已知 c(CO)与反应时间t变化曲线Ⅰ如图2所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ.当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂.当曲线Ⅰ变为曲线Ⅲ时,改变的条件是将容器的体积快速压缩至2L.
(6)用于汽车净化的一个反应2NO(g)+2CO(g)═N2(g)+2CO2(g)在298K、100kPa下能(填“能”或“不能”) 自发进行,原因是△G=△H-T△S=-113.0 kJ•mol-1-298 K×(-145.3 J•mol-1•K-1)×10-3≈-69.7 kJ•mol-1<0,可以自发进行.已知:在298K、100kPa下该反应的△H=-113.0kJ•mol-1,△S=-145.3J•mol-1•K-1.

6.下列说法正确的是( )
| A. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 | |
| B. | 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减少为原来的一半 | |
| C. | 如果盐酸的浓度是醋酸浓度的二倍,则盐酸中氢离子浓度也是醋酸氢离子浓度的二倍 | |
| D. | 物质的量相同的磷酸钠溶液和磷酸溶液中所含的磷酸根离子的量不相同 |
16.下列有关原子结构知识中说法正确的是( )
| A. | 卢瑟福通过α粒子散射实验,证明了电子的存在 | |
| B. | 188O、168O、11H、21H 可以构成六种水分子,他们属于同种物质 | |
| C. | 3717Cl和3517Cl互为同素异形体,最外层电子数都等于7 | |
| D. | 现发现的自然界核素只有100多种,且大多数为金属 |
13.碳单质在工业上有多种用途.
(1)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式是C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
①请结合上表数据,写出NO与活性炭反应的化学方程式C+2NO?N2+CO2.
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=$\frac{9}{16}$.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)ab.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO的转化率的是ab.
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属.若0.5mol碳完全与赤铁矿(Fe2O3)反应,得到0.6mol铁,同时生成2种常见气体CO和CO2,则该反应的化学方程式是5C+3Fe2O3$\frac{\underline{\;高温\;}}{\;}$4CO2↑+CO↑+6Fe.
(1)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式是C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
物质 T/℃n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=$\frac{9}{16}$.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)ab.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO的转化率的是ab.
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属.若0.5mol碳完全与赤铁矿(Fe2O3)反应,得到0.6mol铁,同时生成2种常见气体CO和CO2,则该反应的化学方程式是5C+3Fe2O3$\frac{\underline{\;高温\;}}{\;}$4CO2↑+CO↑+6Fe.