题目内容
16.下列离子检验的不正确的是( )| A. | 某溶液中滴入氯化钡溶液,生成白色沉淀,说明原溶液中可能有SO42- | |
| B. | 某溶液中滴入硝酸银溶液,生成白色沉淀,说明原溶液中可能有Cl- | |
| C. | 某溶液中滴入稀盐酸,生成无色气体,说明原溶液中可能有CO32- | |
| D. | 某溶液中滴入氢氧化钠溶液,生成白色沉淀,说明原溶液中可能有Fe3+ |
分析 A.可能生成AgCl沉淀;
B.可能生成硫酸银、碳酸银等沉淀;
C.不能排出含有HCO3-,也可能生成二氧化硫气体;
D.氢氧化铁为红褐色.
解答 解:A.可能生成AgCl沉淀,如检验是否含有SO42-,应先加入盐酸酸化,如无现象,再加入氯化钡,只能说可能有SO42-,故A正确;
B.可能生成硫酸银、碳酸银等沉淀,如判断是否含有Cl-,应先加入硝酸硝酸酸化,只能说可能有Cl-,故B正确;
C.滴入稀盐酸,生成无色气体,可能为二氧化碳,也可能为二氧化硫,只能说明原溶液中可能有CO32-,但不确定,故C正确;
D.氢氧化铁为红褐色,生成白色沉淀,不能存在Fe3+,故D错误.
故选D.
点评 本题考查物质的检验和鉴别实验方案的设计,为高频考点,把握离子的检验方法、试剂及现象与结论为解答的关键,侧重离子检验的考查,注意检验应排除干扰离子,题目难度不大.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
6.在标准状况下,将22.4L NO2通入过量的NaHCO3溶液中,再使逸出的气体通过装有足量Na2O2颗粒的干燥管,最后收集到的气体是( )
| A. | O2 | B. | CO2和O2 | C. | NO2和O2 | D. | NO |
4.下列是某学生自己总结的一些规律,其中正确的是( )
| A. | 一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物 | |
| B. | 阳离子只能得到电子被还原,只能做氧化剂 | |
| C. | 含有最高价元素的化合物不一定有强的氧化性 | |
| D. | 氧化物不可能是还原产物,只可能是氧化产物 |
11.有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
回答下列问题:
(1)写出下列元素的名称:B、氧,C、钠,D、铝,E、氯;
(2)写出A、B、C形成的化合物M的电子式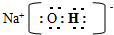 ;
;
(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(4)E单质与M的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构, 且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
(1)写出下列元素的名称:B、氧,C、钠,D、铝,E、氯;
(2)写出A、B、C形成的化合物M的电子式
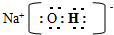 ;
;(3)实验测得DE3在熔融状态下不导电,则DE3中含有的化学键类型为共价键;
(4)E单质与M的水溶液反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O.
1.溶液、胶体和浊液这三种分散系的根本区别是( )
| A. | 是否有丁达尔效应 | B. | 分散质粒子直径的大小 | ||
| C. | 是否能透过滤纸 | D. | 是否为均一、稳定、透明的外观 |
5.下列物质溶于水形成的溶液能导电,但本身是非电解质的是( )
| A. | NaOH | B. | Na2SO4 | C. | SO3 | D. | CH3CH2OH |

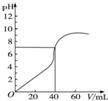 25℃时,用1.0mol•L-1 NaOH溶液中和某浓度H2SO4溶液40mL,其pH和所加NaOH溶液的体积关系如图所示.求:(写出必要的解题过程)
25℃时,用1.0mol•L-1 NaOH溶液中和某浓度H2SO4溶液40mL,其pH和所加NaOH溶液的体积关系如图所示.求:(写出必要的解题过程)