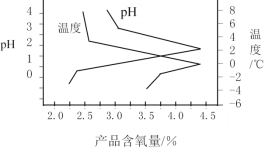
题目内容
【题目】被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种主族元素组成,其化学式为Y2X3(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A.原子半径:Y>Z>R>TB.XR2、WR2两种化合物中R的化合价相同
C.最高价氧化物对应的水化物的碱性:X>ZD.气态氢化物的稳定性:W<R<T
【答案】B
【解析】
香花石化学式为Y2X3(ZWR4)3T2,由前20号元素中的6种组成,其中R原子最外层电子数为其次外层电子数的3倍,R原子只能有2个电子层,最外层电子数为6,则R为O元素;Y、Z、R、T位于同一周期,即处于第二周期,T元素无正价,则T为F元素;Z的最外层电子数与次外层电子数相等,则Z为Be元素;Y为金属元素,则Y为Li;X、Z位于同主族,则X为Mg元素或Ca元素,若X为镁元素,则由X与R原子序数之和是W的2倍,则![]() =10,推出W为Ne元素,不符合题意;若X为Ca元素,则由X与R原子序数之和是W的2倍,则
=10,推出W为Ne元素,不符合题意;若X为Ca元素,则由X与R原子序数之和是W的2倍,则![]() =14,推出W为Si元素,符合题意,据此解答。
=14,推出W为Si元素,符合题意,据此解答。
根据上述分析可知:X是Ca,Y是Li,Z是Be,W是Si,R是O,T是F元素。
A.Y为锂元素、Z为铍元素、R为氧元素、T为氟元素,位于同一周期,元素的原子半径从左向右半径逐渐减小,即原子半径:Y>Z>R>T,A正确;
B.XR2、WR2两化合物CaO2、SiO2,CaO2中O元素为-1价,SiO2中O元素化合价为-2,B错误;
C.X为钙元素、Z为铍元素,元素的金属性:Ca>Be。元素的金属性越强,其最高价氧化物对应的水化物的碱性就越强,所以最高价氧化物对应的水化物碱性:Ca(OH)2>Be(OH)2,C正确;
D.W为硅元素、R为氧元素、T为氟元素,元素的非金属性越强,其相应的简单氢化物的稳定性就越强。元素的非金属性F>O>Si,则气态氢化物的稳定性W<R<T,D正确;
故合理选项是B。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案