题目内容
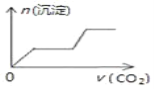
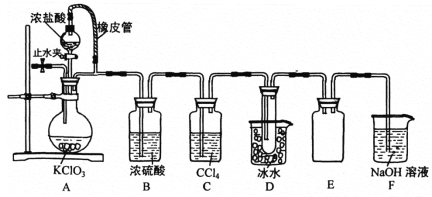
【题目】向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )
A. 1∶1∶2B. 2∶2∶1
C. 1∶2∶2D. 9∶2∶4
【答案】C
【解析】
根据图象分析,A点时沉淀的量最大,沉淀是氢氧化铝和氢氧化镁,从A点到B点,沉淀的质量减少,减少的量是氢氧化铝,氢氧化铝的物质的量为0.2mol,不溶解的沉淀是氢氧化镁,其物质的量是0.1mol,根据原子守恒确定镁离子、铝离子的物质的量;根据A点过氧化钠物质的量计算生成氧气的物质的量,根据气体总的物质的量计算生成氨气的物质的量,根据氮原子守恒从而计算铵根离子的物质的量。
由图知,沉淀中含0.1mol Mg(OH)2和0.2molAl(OH)3,即原溶液中含Mg2+0.1mol,含Al3+0.2mol,根据Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,沉淀2种金属阳离子共需NaOH的物质的量为0.1mol×2+0.2mol×3=0.8mol。由图中横坐标知与3种阳离子恰好完全反应时需Na2O20.5mol,而0.5molNa2O2与水反应生成1molNaOH和0.25molO2,由NH4++OH-![]() NH3↑+H2O,所以由NH4+消耗NaOH的量(1mol-0.8mol=0.2mol)或生成NH3的物质的量(0.45mol-0.25mol=0.2mol)均可求得原溶液中含0.2molNH4+,所以Mg2+、NH4+、Al3+物质的量之比=0.1mol:0.2mol:0.2mol=1:2:2;
NH3↑+H2O,所以由NH4+消耗NaOH的量(1mol-0.8mol=0.2mol)或生成NH3的物质的量(0.45mol-0.25mol=0.2mol)均可求得原溶液中含0.2molNH4+,所以Mg2+、NH4+、Al3+物质的量之比=0.1mol:0.2mol:0.2mol=1:2:2;
故合理选项是C。

【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
| IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素②的原子结构示意图为_____。
(2)元素③、④、⑤、⑥原子半径由大到小为_____。
(3)上述 8 种元素中,非金属性最强的是_____。
(4)元素②、③形成的气态氢化物稳定性:_____>_____;元素①、③、⑤可形成既含离子键又含极性共价键的化合物,写出其电子式:_____。
(5)元素⑦的最高价氧化物对应的水化物与元素⑤最高价氧化物对应的水化物溶液反应的离子方程式为_____。
(6)写出金属铜与②最高价氧化物对应的水化物稀溶液反应的离子方程式_____。
(7)从原子结构的角度解释元素③和⑦的非金属性强弱:_____
【题目】某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成。请回答下列问题:
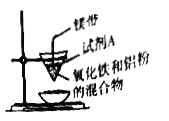
(l)铝热反应原理____________(写化学方程式);试剂A为_____(写化学式)。实验现象:_________、有褐色固体生成。
(2)将褐色硬块处理成粉未状,研究小组首先排除了含有单质Al杂质的可能性。
实验方法:首先取少量粉未加入_____溶液中;
实验现象:__________;实验结论是:粉末中含有Al2O3而没有Al。
(3)根据上述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。提出假设:
假设l:固体粉末中除Al2O3外还有Fe;
假设II:固体粉末中除Al2O3外还有Fe和Fe2O3。
设计方案并实验:
实验步骤 | 实验现象 | 实验结论 |
①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设II不成立 |
②再滴入几滴0.01mol/L KSCN 溶液 | 溶液不变色 |
你认为上述结论是否合理,_________,理由是_______________。
(4)取上述实验所得溶液,滴入适量氯水溶液变红色。此时涉及的离子反应方程式为:_________________、____________。