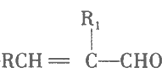
题目内容
【题目】某化学兴趣小组利用如图装置进行铝热反应实验,发现生成的铁呈疏松的褐色硬块。小组成员推测主要原因是产物铁含杂质较多,并进一步探究该褐色硬块的组成。请回答下列问题:

(l)铝热反应原理____________(写化学方程式);试剂A为_____(写化学式)。实验现象:_________、有褐色固体生成。
(2)将褐色硬块处理成粉未状,研究小组首先排除了含有单质Al杂质的可能性。
实验方法:首先取少量粉未加入_____溶液中;
实验现象:__________;实验结论是:粉末中含有Al2O3而没有Al。
(3)根据上述实验判断该褐色硬块的组成基本确定为Fe、Fe2O3、Al2O3。提出假设:
假设l:固体粉末中除Al2O3外还有Fe;
假设II:固体粉末中除Al2O3外还有Fe和Fe2O3。
设计方案并实验:
实验步骤 | 实验现象 | 实验结论 |
①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设II不成立 |
②再滴入几滴0.01mol/L KSCN 溶液 | 溶液不变色 |
你认为上述结论是否合理,_________,理由是_______________。
(4)取上述实验所得溶液,滴入适量氯水溶液变红色。此时涉及的离子反应方程式为:_________________、____________。
【答案】 Fe2O3+2Al![]() Al2O3+2Fe KClO3(或Na2O2) 火星四射,有强光(或放出大量的热) NaOH溶液 粉末部分溶解,但没有气泡产生 不合理 Fe2O3与酸反应生成的Fe3+余Fe反应生成Fe2+,滴入KSCN溶液后也不变色 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-
Al2O3+2Fe KClO3(或Na2O2) 火星四射,有强光(或放出大量的热) NaOH溶液 粉末部分溶解,但没有气泡产生 不合理 Fe2O3与酸反应生成的Fe3+余Fe反应生成Fe2+,滴入KSCN溶液后也不变色 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-![]() Fe(SCN)3
Fe(SCN)3
【解析】(l)通过本题图可以看出铝热反应为氧化铁和铝的反应,其反应方程式为Fe2O3+2Al![]() Al2O3+2Fe;试剂A的作用是加热产生氧气,帮助燃烧,促进反应反应快速进行,一般选取的是KClO3或Na2O2.此反应非常剧烈,在反应过程中会有火星四射的现象,同时伴有有强光,并放出大量热,生成黑色的金属固体铁
Al2O3+2Fe;试剂A的作用是加热产生氧气,帮助燃烧,促进反应反应快速进行,一般选取的是KClO3或Na2O2.此反应非常剧烈,在反应过程中会有火星四射的现象,同时伴有有强光,并放出大量热,生成黑色的金属固体铁
(2)金属铝可以和氢氧化钠发生反应产生氢气,所以可以取少量粉末加入NaOH溶液中,结果没有产生气泡证明粉末中含有Al2O3而没有Al;
(3)含有Fe3+的溶液与KSCN溶液混合后溶液会变红,如果没有Fe3+离子,加入KSCN溶液混合后溶液也不会变红.由于固体全部溶解,在这个过程中Fe3O4与酸反应生成的Fe3+可能与Fe反应生成Fe2+,这样溶液也不变红.故结论不合理,应该确认铁溶解后Fe3+还有剩余才能变红;
(4)取上述实验所得溶液,滴入适量氯水,溶液变红色,说明溶液中含有Fe2+,而Cl2能把Fe2+氧化成Fe3+,发生反应2Fe2++Cl2=2Fe3++2Cl-,Fe3+和SCN-生成配合物,发生反应Fe3++3SCN-=Fe(SCN)3。

【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同