题目内容
【题目】(2015·江苏化学,18,12分)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O,反应的化学方程式为:MnO2+SO2===MnSO4。
(1)质量为17.40 g纯净MnO2最多能氧化________L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6 mol·L-1),需调节溶液pH范围为________。
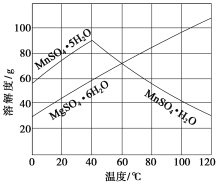
(3)如图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制的结晶温度范围为________________________。
(4)准确称取0.171 0 g MnSO4·H2O样品置于锥形瓶中加入适量H3PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.050 0 mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00 mL。计算MnSO4·H2O样品的纯度(请给出计算过程)。
【答案】(1)4.48;(2)5.0<pH<7.1;(3)高于60℃;(4)根据氧化还原反应中得失电子守恒:n(Mn3+)×1=n(Fe2+)×1=20.00×10-3×0.0500mol=1.00×10-3mol,根据Mn元素守恒,m(MnSO4·H2O)=1.00×10-3×169g=0.169g,纯度是:0.169/0.1710×100%=98.8%。
【解析】(1)根据反应方程式,n(SO2)=n(MnO2)=17.4/87mol=0.2mol,合0.2×22.4L=4.48L;(2)制备MnSO4,再根据信息,pH小于7.1,氢氧化铝完全变成沉淀时的pH:Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-6mol·L-1,得出:c(OH-)=1×10-9mol·L-1,c(H+)=Kw/c(OH-)=10-5,pH=5,同理计算出Fe(OH)3完全变成沉淀时,pH约为3.5,故范围是:5.0<pH<7.1;(3)从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,根据图上信息,高于60℃以后MnSO4·H2O的溶解度减小,而MgSO4·6H2O的溶解度增大,因此控制结晶温度范围是高于60℃,这样可以得到纯净的MnSO4·H2O;(4)根据氧化还原反应中得失电子守恒:n(Mn3+)×1=n(Fe2+)×1=20.00×10-3×0.0500mol=1.00×10-3mol,根据Mn元素守恒,m(MnSO4·H2O)=1.00×10-3×169g=0.169g,纯度是:0.169/0.1710×100%=98.8%。

 智能训练练测考系列答案
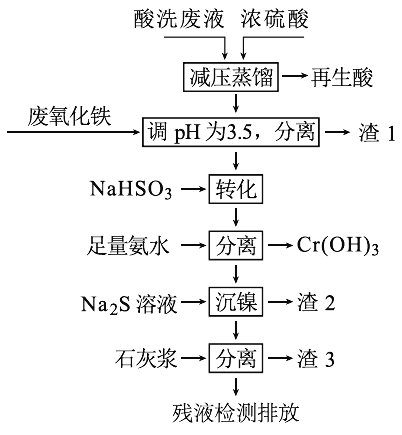
智能训练练测考系列答案【题目】用HNO3和HF的混酸处理某金属后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和Cr2O72-等。下图是综合利用该酸洗废液的工艺流程:
已知:
金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3 ![]() [Ni(NH3)6]2+
[Ni(NH3)6]2+
(1)再生酸中含有HNO3,采取减压蒸馏的目的为____________,
(2)滤渣1的主要成份为:____________。
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的氧化剂与还原剂的物质的量之比:________。
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:____________。
(5)滤渣3的主要成分为CaSO4、Ca(OH)2和_____。
(6)经检测,最后的残液中c(Ca2+)=0.001 molL-1,则残液中F-浓度为____mgL-1,______(填“符合”或“不符合”)排放标准[已知Ksp(CaF2)=4×10-11,国家排放标准要求氟离子浓度小于10 mgL-1]。