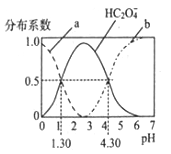
题目内容
【题目】铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)铬元素基态原子的电子排布式为_________;硫酸铜溶于氨水,形成[Cu(NH3)4]SO4溶液,[Cu(NH3)4]SO4中阴离子的立体构型是______,_________接受孤对电子对;金属铜的堆积方式为______。
(2)制备Cr2O2Cl2的反应式为K2Cr2O2+3CCl4=2KCl+2Cr2O2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由小到大的顺序是_____________(用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中中心原子的杂化方式为________,COCl2分子中ɑ键和π键的个数比为__________。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同。其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO_________FeO(填“>”、“<”或“=”)。
(4)Cu和Ca的合金呈粉末状,极易被氧化,其晶胞结构如图所示:
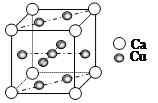
①该晶体的化学式为_________,铜和钙两种金属相比铜的熔点比钙高,其原因是_______。
②已知该晶胞的密度为dg·cm-3,Ca半径为r1cm,Cu半径为r2cm,设NA为阿伏伽德罗常数,则该晶胞的空间利用率为________(用含d、r1、r2、NA的代数式表示)。
【答案】 [Ar]3d54s1 正四面体形 Cu 面心立方最密堆积 O>Cl>C sp2 3:1 > CaCu5 铜的金属键比钙的强,铜的熔点比钙高 (πr13+5πr23)dNA/360
【解析】(1)铬元素的核电荷数为24,基态原子的电子排布式为[Ar]3d54s1;SO42-离子中价层电子对数为4+![]() ×(6+2-4×2)=4,孤电子对数为0,所以是正四面体体型;接受孤对电子对的是中心原子Cu;金属铜的堆积方式为面心立方最密堆积;
×(6+2-4×2)=4,孤电子对数为0,所以是正四面体体型;接受孤对电子对的是中心原子Cu;金属铜的堆积方式为面心立方最密堆积;
(2)①反应式中非金属元素有三种:O、C、Cl,CCl4中C表现正化合价、Cl表现负化合价,CrO2Cl2中Cl为+1价,O为-2价,电负性越大,对键合电子吸引力越大,元素相互化合时该元素表现负价,故电负性:O>Cl>C;
②COCl2分子中有1个C=O键和2个C-Cl键,所以COCl2分子中σ键的数目为3,π键的数目为1,个数比3∶1,中心原子C电子对数=3+![]() =3,故中心原子杂化方式为sp2;
=3,故中心原子杂化方式为sp2;
③NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高,由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO;
(4)①晶胞中Cu原子数为8×![]() +1=5,Ca原子数为8×
+1=5,Ca原子数为8×![]() =1,该晶体的化学式为CaCu5;铜和钙两种金属相比铜的熔点比钙高,其原因是铜的金属键比钙的强,所以铜的熔点比钙高;
=1,该晶体的化学式为CaCu5;铜和钙两种金属相比铜的熔点比钙高,其原因是铜的金属键比钙的强,所以铜的熔点比钙高;
②设晶胞边长为acm,则晶胞的体积为a3cm3,NA个晶胞和质量为(40+64×5)=360g,晶胞的密度dg·cm-3=360g÷(a3cm3×NA)则a3cm3=cm3,该晶胞的空间利用率为(πr13+5πr23)÷a3=(πr13+5πr23)dNA/360。