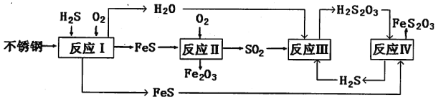
题目内容
【题目】甲图为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能;乙图是含Cr2O72-酸性废水的处理装置。将甲、乙两装置连接[Fe(Ⅱ)极与X极连接],可将Cr2O72-转化成Cr(OH)3沉淀而除去。下列说法错误的是
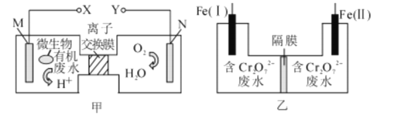
A.若废水中含有乙醛,则M极的电极反应为:CH3CHO+2H2O-8e-=2CO2↑+8H+,
B.电解一段时间后,在Fe(I)极附近有沉淀析出
C.装置乙的隔膜是阳离子交换膜
D.电路中每转移3 mol电子,最多有0.5 mol Cr2O72-被还原
【答案】CD
【解析】
甲装置为原电池装置,根据装置图以及原电池工作原理,M极为负极,N极为正极,Fe(II)与X电极相连,则Fe(II)为阴极,Fe(I)为阳极,即乙装置为电解池,然后利用原电池工作原理和电解池工作原理进行分析;
A. 甲装置是利用一种微生物将有机废水的化学能直接转化为电能,即甲装置为原电池,根据原电池工作原理,M极为负极,若废水中含有乙醛,则其电极反应式为CH3CHO+2H2O-8e-=2CO2↑+8H+,故A正确;
B. Fe(I)连接Y,即Fe(I)为阳极,电极反应式为Fe-2e-=Fe2+,该区域发生氧化还原反应6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,Fe(II)电极为阴极,电极反应式为2H++2e-=H2↑,H+不断在阴极上得电子成为H2而析出,且Cr2O72-与Fe2+的反应也在消耗H+,使得溶液酸性变为中性,再由中性变为碱性,Cr3++3OH-=Cr(OH)3↓,Fe3++3OH-=Fe(OH)3↓,因隔膜为离子交换膜,因此Fe(I)附近有沉淀产生,故B正确;
C. 根据乙装置以及B选项分析,乙装置右侧中Cr2O72-向左侧移动,则隔膜为阴离子交换膜,故C错误;
D. 根据B选项分析,建立12e-~6Fe2+~Cr2O72-,每转移3mol电子,最多有![]() =
=![]() molCr2O72-被还原,故D错误;
molCr2O72-被还原,故D错误;
答案:CD。